Amidas
- 3221
- 353
- Lonnie MacGyver
Explicamos o que os casos, suas características, estrutura, tipos, nomenclatura e damos vários exemplos
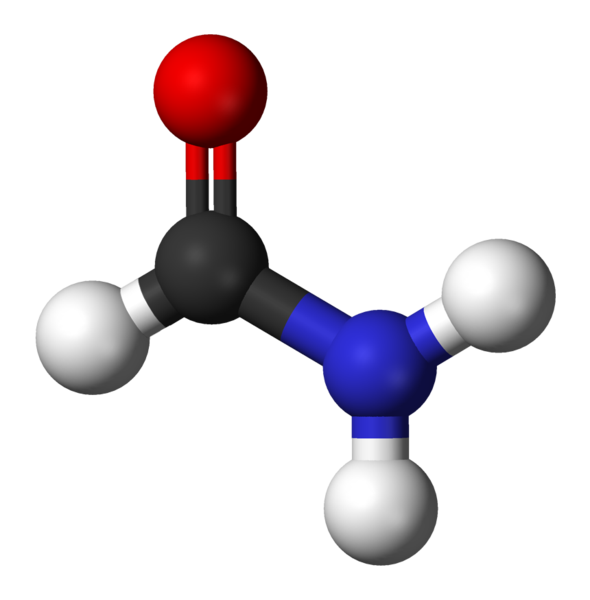
 Formamida, o mais simples Amida
Formamida, o mais simples Amida Quais são os amidas?
Amidas são um tipo de compostos orgânicos que são formados pela união entre um ácido carboxílico e uma amina. Eles também são chamados de aminas ácidas e a partir daí é precisamente de onde a palavra vem amida.
Esses compostos são muito importantes para a vida, pois são uma parte essencial de proteínas, peptídeos e alguns hormônios. Eles também fazem parte das bases nitrogenadas de DNA e RNA, que contêm nossa informação genética.
Amidas também são muito importantes na indústria. Por exemplo, O nylon É uma das fibras sintéticas mais usadas em todo o mundo e é formada por uma longa cadeia de amidas unidas uma após a outra.
Além disso, as amidas são muito usadas na indústria farmacêutica, pois fazem parte de medicamentos como a lidocaína.
Características das amidas
- Quase todos são sólidos: Todas as amidas são sólidas à temperatura ambiente, exceto a menor e mais simples que é a formamida. O último é líquido.
- Eles têm um ponto de ebulição alto: Comparados aos ácidos carboxílicos e aminas das quais são feitas, as amidas têm um ponto de ebulição alto. Por exemplo, acetamida (escolha3CONH2) É formado pela união do ácido acético (vinagre) com amônia. O ponto de ebulição da acetamida é 221,2 ºC, enquanto o do ácido acético é de 118 ºC e a amônia é -33,34 ºC.
- Alguns são solúveis em água: Os menores amidas se misturam bem com a água, por isso é fácil dissolvê -los nele. No entanto, à medida que se tornam maiores, eles se tornam menos solúveis.
- Eles são menos básicos que as aminas: Um amida é sempre menos básico (ou mais ácido) do que a amina da qual vem. De fato, o nome Amida vem da combinação a mimNa+acidá.
- Seu link está facilmente quebrado: Se uma base forte como um catalisador for adicionada, as amidas reagem rapidamente com a água. Essa reação é chamada de hidrólise e, durante o mesmo.
- Eles são incolores e banheiros: Em geral, as amidas são substâncias que não têm um cheiro de cor ou característica.
Estrutura do grupo funcional
Quimicamente, o Amida é um grupo funcional que contém um grupo carbonil (C = O) de um ácido carboxílico, ligado ao nitrogênio da amônia ou amina. A estrutura geral das amidas é:
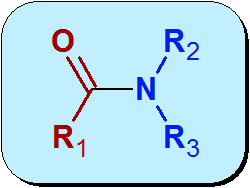 A parte vermelha da molécula na imagem anterior vem do ácido carboxílico e é chamado Acil. A parte azul vem da amida.
A parte vermelha da molécula na imagem anterior vem do ácido carboxílico e é chamado Acil. A parte azul vem da amida.
Uma característica da estrutura dos casos que os distingue das aminas é que o par de elétrons livres que o nitrogênio o possui com o grupo carbonil por meio de um processo chamado ressonância. É isso que torna os casos menos básicos que os aminas.
Tipos de amidas
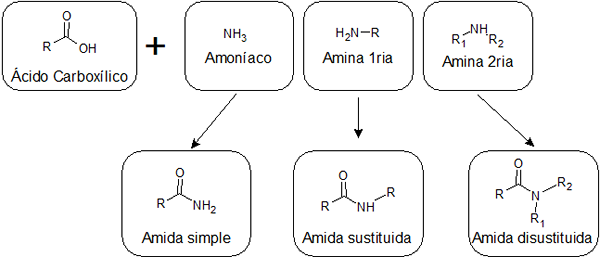
Dependendo se o ácido é combinado com a amônia, com uma amina primária ou com uma amina secundária, três tipos de amidas com estruturas diferentes podem ser obtidas:
Amidas simples
Eles são formados pela união entre um ácido carboxílico e a amônia. Este tipo de amida tem um grupo -NH2 Ligado ao grupo carbonil. Amides simples podem formar várias ligações de hidrogênio entre si e com água, então elas geralmente são mais solúveis do que as substituídas.
- Exemplos simples de amida: formamida, acetamida e butiramida.
Amidas substituídas
Eles são obtidos pela união de um ácido e uma amina primária. Nesse caso, um dos hidrogênios de -nh2 Das amidas simples são substituídas por um alquil, e é por isso que eles são informados.
- Exemplo de uma amida substituída: O vínculo entre aminoácidos em proteínas.
Amidas não craques
Eles vêm da reação entre um ácido e uma amina secundária. Nesse caso, ambos os hidrogênios do grupo -NH2 Eles são substituídos por grupos alquil. As amidas dissogadas não têm hidrogênio ligado a nitrogênios, para que não possam formar pontes de hidrogênio entre si, e apenas um fraco com água. Isso os torna menos solúveis na água do que os outros tipos de amidas.
Lactamas, primário, secundário e terciário Amidas
Além dos três tipos de amidas recém -mencionadas, também existem Amidas primárias, secundárias e terciárias, que diferem por ter um, dois ou três grupos ácidos unidos ao átomo de nitrogênio.
Finalmente, algumas amidas formam ciclos fechados. Nesse caso, o composto é chamado lactam. As lactamas são muito importantes na natureza. Por exemplo, o uracil que faz parte do RNA é uma lactama.
Nomenclatura de Amidas
Amidas simples
As amidas simples são nomeadas do nome da cadeia de carbono do ácido do qual elas vêm (a cadeia principal). O nome é construído colocando o prefixo indicando o número de carbonos (metan-, butan-, hexan-, etc.) ou o nome comum do ácido removendo o término -oico ou -ico (como em acético) E adicionando a terminação -amida.
- Exemplo: a amida que vem do ácido acético é chamada acetamida e a que vem do ácido propanóico é chamada de propanamida.
Amides substituídos e discapsos
Nesse caso, começa a nomear os grupos alquil unidos ao nitrogênio, precedidos pela letra n-. Então o resto do Amida é nomeado como a cadeia principal.
Pode atendê -lo: enxofre: história, propriedades, estrutura, obtenção, usoExemplo:
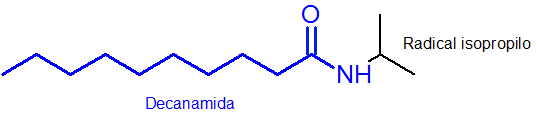 Como pode ser visto, o substituinte que é anexado ao nitrogênio é um grupo isopropil, por isso está incluído no nome como n -iosopropil (o último "O" é sempre removido ao nome do radical).
Como pode ser visto, o substituinte que é anexado ao nitrogênio é um grupo isopropil, por isso está incluído no nome como n -iosopropil (o último "O" é sempre removido ao nome do radical).
O restante da cadeia principal, que possui o grupo funcional amida, possui 10 átomos de carbono. Isto é, seu nome deve ter o prefixo deCan- seguido pela terminação amida ou, decanamida. Então o O nome completo é n-ospropildecanamide.
Exemplos de amidas
- Benzamida c6H5CONH2
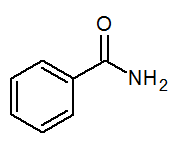
- N, n-dimetilacetamida CH3Com (cap3)2
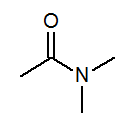
- Acetamida cap3CONH2
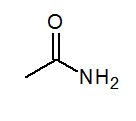
- Fenilacetamida (c6H5) CH2CONH2
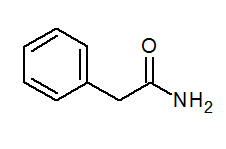
- N-butil-n-propilformamida HCON (C3H7) (C4H9)
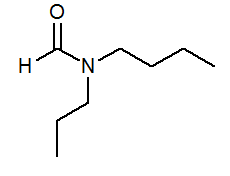
- 4-hidroxibanamida cap2(Oh) Cho2CH2CONH2
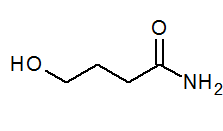
- Urerea Co (NH2)2
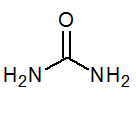
- Propanamida cap3CH2CONH3
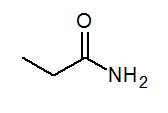
- N-butil-2-ecopilpetanamida cap3CH2CH2Ch (c3H7) CONH (C4H9)

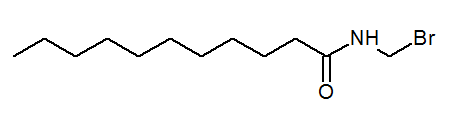
- N- (bromometil) Undecanamida Cho3(CH2)9CONHCH2Br
Referências
- Britannica, t. Editores da Encyclopaedia (2019, 15 de maio). Amida. Enciclopédia Britannica. Tirado de Britannica.com
- Amis- estruturas e nomes. (2020, 17 de agosto). Retirado de Chem.Librettexts.org
- Carey, f. PARA. (2008). Química orgânica. Boston: McGraw-Hill Ensino Superior.
- Smith, m., Março, j., E março, J. (2001). Química orgânica avançada de março: reações, mecanismos e estratégia. Nova York: Wiley.
- Zabicky, J. (1970). A química do amis, parte 1. Nova York: Wiley

