Estrutura Alcoólica Isoamilica, Propriedades, Usos e Riscos
- 3414
- 43
- Mr. Reginald Lindgren
Ele Álcool isoamílico É um composto orgânico cuja fórmula é (ch3)2Chch2CH2Oh. Quimicamente falando é um álcool primário ramificado e constitui um dos isômeros de pentanol, chamados álcoois amílicos (C5H12QUALQUER).
Como muitos álcoois de baixo peso molecular, é um líquido incolor à temperatura ambiente. Isso permite e facilita que seja usado como solvente para diferentes aplicações; Além disso, quando não exerce muitos efeitos negativos no ecossistema depois de descartar.
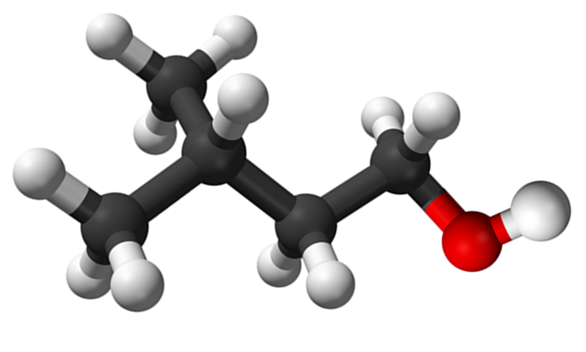
 Molécula de álcool isoamílico. Fonte: Claudio Pistilli de Wikipedia.
Molécula de álcool isoamílico. Fonte: Claudio Pistilli de Wikipedia. Embora seja um material intermediário na síntese de acetato de amilo para a elaboração de fragrâncias de banana, seu próprio cheiro é desagradável e semelhante ao das peras.
Além de servir como um solvente de múltiplas substâncias biológicas e como intermediário na síntese de outros acetatos, reduz a tensão superficial de certas formulações industriais, impedindo que as espumas se formem. Portanto, é usado em sistemas microemulsionados.
Em relação à sua origem natural, o álcool isoamílico foi encontrado nos Horomonas do Hornets e nas trufas negras, um tipo de fungos localizado no sudeste europeu.
[TOC]
Estrutura isoamilica
Na imagem superior, foi mostrada a molécula de álcool isoamílico representada com um modelo de esferas e barras. À direita da mesma, a esfera avermelhada corresponde ao átomo de oxigênio do grupo OH, característico de todos os álcoois; Enquanto à esquerda, há o esqueleto carbonatado com um grupo metil, CHO3, Brincadeamento da estrutura.
Do ponto de vista molecular, esse composto é dinâmico para ter átomos com hibridações de SP3, facilitar a rotação de seus vínculos; Contanto que isso não faça com que o OH e Cho eclipse3.
Também vale a pena mencionar sua característica anfifílica: possui uma extremidade apolar ou hidrofóbica, constituída pela cadeia (CH3)2Chch2CH2-, e uma cabeça polar ou hidrofílica, o grupo OH. Essa definição de duas áreas específicas de diferentes polaridades tornam esse álcool um tensivo; E daqui é devido ao seu pedido de microemulsões.
Pode atendê -lo: regra de alavancaInterações intermoleculares
Dada a presença do grupo OH, a molécula isoamílica de álcool apresenta um momento de dipolo permanente. Consequentemente, o dipolo-dipol.
Enquanto o ramo das principais correntes diminui as interações efetivas entre as moléculas, as pontes de hidrogênio nesse álcool compensam essa descida, fazendo com que o líquido ferva a 131 ° C, temperatura superior ao ponto de ebulição da água.
Isso não acontece com seu sólido ou "gelo", que derrete a -117 ° C, indicativo de que suas interações intermoleculares não são fortes o suficiente para manter suas moléculas ordenadas; especialmente se o grupo CHO3 que ramifica a cadeia principal impede melhor contato entre moléculas.
Propriedades
Aparência física
Líquido incolor.
Cheiro e sabor
Descarta um cheiro desagradável semelhante ao da pêra e tem um sabor agudo.
Massa molar
88.148 g/mol.
Densidade
0,8104 g/ml a 20 ° C. Portanto, é menos denso que a água.
Densidade do vapor
É 3,04 vezes mais denso que o ar.
Pressão de vapor
2,37 mmHg a 25 ° C.
Ponto de ebulição
131,1 ° C.
Ponto de fusão
-117,2 ° C.
ponto de ignição
43 ° C (copo fechado).
Temperatura de auto -dirigir
340 ° C.
Solubilidade
É relativamente solúvel em água: 28g/l. Isso ocorre porque as moléculas altamente polares da água não sentem afinidade especial para a cadeia alcoólica isoamílica carbonatada. Se mistas, duas fases seriam observadas: uma mais baixa, correspondente à água e um superior, a de álcool isoamílico.
Por outro lado, é muito mais solúvel em solventes menos polares, como: acetona, éter, clorofórmio, etanol ou ácido acético glacial; E mesmo em éter de petróleo.
Pode servir a você: Termômetro de laboratório: características, para que serve, uso, exemplosGosma
3.738 cp a 25 ° C.
Tensão superficial
24,77 Dins/cm a 15 ° C.
Índice de refração
1.4075 a 20 ° C.
Capacidade de calor
2.382 kJ/g · k.
Formulários
Matéria prima
De álcool isoamílico, outros ésteres, tiofeno e drogas como amilo nitrito, validol (isavalerate mentile), bromisovação (bromobalerilurea), corvalol (um tranquanar de Callerian) e Barbamil (Amobarbital) (Amobarbital).
Fragrâncias
Além de ser usado para a síntese de acetato de amilo, que possui um aroma de banana, outras fragrâncias de frutas, como damasco, laranjas, ameixa, cereja e malte, também são obtidas a partir dela. Portanto, é um álcool necessário na elaboração de inúmeros produtos comestíveis ou de cosméticos.
Antispumante
Ao reduzir a tensão superficial, promove seu uso em sistemas microemulsionados. Praticamente, evite a formação acelerada de bolhas, reduzindo -os em tamanho para quebrá -los.
Também ajuda a definir melhor a interface entre fases aquosas e orgânicas durante extrações; Por exemplo, é adicionado à mistura de extrator de fenol-clorofórmio em uma proporção de 25: 1. Esta técnica é destinada à extração de DNA.
Extrações
O álcool isoamílico também permite extrair gorduras ou óleos de diferentes amostras, por exemplo, leite. Além disso, dissolve cera de parafina, tintas, borracha, lacas e ésteres de celulose.
Continuando com extrações, com ele você pode obter ácido fosfórico de soluções minerais fosfáticas de ferro.
Riscos
Armazenamento e reatividade
Como qualquer líquido que emite odores, ele pode representar um risco iminente de incêndio se o local onde sua temperatura estiver muito armazenada, ainda mais se houver uma fonte de calor.
Sob essas condições, simplesmente atua como um combustível, alimentando as chamas e até explorando seu contêiner. Ao queimar, libere vapores que podem afetar a saúde e causar asfixia.
Pode atendê -lo: análise quantitativa em química: medições, preparaçãoOutras causas que o álcool isoamílico é incendiado é misturá -lo ou fazê -lo reagir com substâncias como: peróxidos, brome.
Saúde
Em contato com a pele, você pode irritar e secar. Os sintomas, no entanto, são mais sérios se forem inalados por muito tempo (tosse, queimaduras no nariz, garganta e pulmões), ou se ingeridos (dor de cabeça, náusea, diarréia, vômito, tontura e perda de conhecimento).
E finalmente, quando se derrama nos olhos os irritam e pode até prejudicá -los irreversivelmente. Felizmente, seu cheiro de "peras alcoólicas" permite que você o detecte em caso de fuga ou derramamento; Além disso, é um composto que deve ser manipulado com respeito.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.
- Wikipedia. (2019). Álcool isoamílico. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Álcool isoamílico. Banco de dados PubChem. CID = 31260. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Zhang Yu & Muhammed Mamoun. (17 de setembro de 2008). Extração de ácido fosfórico de soluções de nitrato com álcool isoamílico. Extração de solventes e volume de troca iônica 6, 1988 - Edição 6. doi.org/10.1080/07366298808917973
- Departamento de Saúde de Nova Jersey. (2008). Álcool isoamílico. [PDF]. Recuperado de: NJ.Gov
- Kat Chem. (2019). Álcool isoamílico. Recuperado de: kat-chem.Hu
- Chemoxy International Ltd. (s.F.). Álcool isoamílico. Recuperado de: quimioxi.com
- « Estrutura da trietilamina, propriedades, usos e riscos
- História e significado da bandeira de Liechtenstein »

