Estrutura da trietilamina, propriedades, usos e riscos

- 2125
- 249
- Melvin Mueller
O trietilamina É um composto orgânico, mais precisamente uma amina alifática, cuja fórmula química é n (CH2CH3)3 ou rede3. Como outras aminas líquidas, apresenta um cheiro semelhante ao da amônia misturada com peixes; Seus vapores tornam tedioso e perigoso manipular esta substância sem um extrator ou roupa apropriado.
Além de suas respectivas fórmulas, geralmente é abreviado a este composto como TEA; No entanto, isso pode causar confusão com outras aminas, como a trietanolamina, n (Ethoh)3, ou o tetraetilamônio, uma amina quaternária, rede4+.
 Esqueleto de trietilamina. Fonte: Misturas [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]
Esqueleto de trietilamina. Fonte: Misturas [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]] De seu esqueleto (imagem superior), pode -se dizer que a trietilamina é bastante semelhante à amônia; Enquanto o segundo tem três hidrogênios, NH3, O primeiro tem três grupos etílicos, n (CH2CH3)3. Sua síntese começa com o tratamento da amônia líquida com etanol, ocorrendo uma alquilação.
A rede3 Você pode formar um sal higroscópico com HCl: cloridrato de trietilamina, rede3· Hcl. Além disso, ele participa como um catalisador homogêneo na síntese de ésteres e amidas, por isso é um solvente necessário em laboratórios orgânicos.
Além disso, juntamente com outros reagentes, permite a oxidação de álcoois primários e secundários em aldeídos e cetonas, respectivamente. Como a amônia é uma base e, portanto, pode formar sais orgânicos através de reações de neutralização.
[TOC]
Estrutura da trietilamina
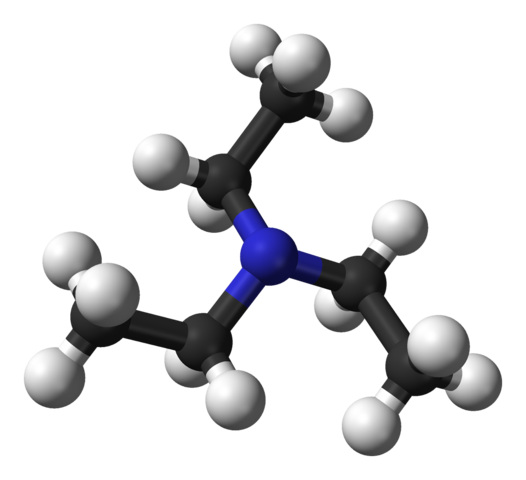 Estrutura da trietilamina. Fonte: Benjah-BMM27 [Domínio Público].
Estrutura da trietilamina. Fonte: Benjah-BMM27 [Domínio Público]. A imagem superior mostra a estrutura da trietilamina com um modelo de esferas e barras. No centro da molécula, o átomo de nitrogênio está localizado, representado por uma esfera azulada; E ligado a ele, os três grupos etílicos, como pequenos galhos de esferas pretas e pretas.
Embora não estejam a olho nu, no átomo de nitrogênio, existem alguns elétrons não compartilhados. Esses dois elétrons e os três grupos -Ch2CH3 Eles experimentam repulsões eletrônicas; Mas, por outro lado, eles contribuem para definir o momento dipolar da molécula.
Pode atendê -lo: Cycloalcanos: propriedades, reações, usos, exemplosNo entanto, esse momento dipolar é menor do que o de, por exemplo, dietilamina, NHET2; E também, não tem possibilidade de formar pontes de hidrogênio.
Isso ocorre porque na trietilamina não há ligação n-h e, consequentemente, pequenos pontos de fusão e ebulição são observados em comparação com outras aminas que interagem de tal maneira.
Embora exista um leve momento dipolar, as forças de dispersão entre grupos etílicos de moléculas líquidos não podem ser descartadas3 vizinhos. Adicionando esse efeito, é justificado por que, embora a trietilamina seja volátil, ele ferve cerca de 89ºC, graças à sua massa molecular relativamente grande.
Propriedades
Aparência física
Líquido incolor com cheiro desagradável de amônia e peixe.
Massa molar
101.193 g/mol.
Ponto de ebulição
89ºC.
Ponto de fusão
-115ºC. Observe quão fracos são as forças intermoleculares que unem as moléculas de trietilamina em seu sólido.
Densidade
0,7255 g/ml.
Solubilidade
É relativamente solúvel em água, 5,5 g/100g a 20ºC. Abaixo de 18,7 ºC, de acordo com o PubChem, é até miscível com isso.
Além de "se dar bem" com água, também é solúvel em acetona, benzeno, etanol, éter e parafina.
Densidade do vapor
3.49 em relação ao ar.
Pressão de vapor
57,07 mmHg a 25ºC.
Henry Constant
66 μmol/pa · kg.
ponto de ignição
-15ºC.
Temperatura de auto -dirigir
312ºC.
Capacidade de calor
216,43 KJ/mol.
Calor de combustão
10.248 cal/g.
Calor de vaporização
34,84 kJ/mol/mol.
Tensão superficial
20,22 n/m a 25ºC.
Índice de refração
1.400 a 20ºC.
Gosma
0,347 MPA · S a 25ºC.
Constante de basicidade
A trietilamina tem um PKB igual a 3,25.
Basicidade
A basicidade para esta amina pode ser expressa pela seguinte equação química:
Pode atendê -lo: polímeros sintéticosLíquido3 + Ha nhet3+ + PARA-
Onde é uma espécie de ácido fraco. O par NHET3+PARA- Forma o que se torna um sal de amônio terciário.
Ácido conjugado do NHET3+ É mais estável que amônio, NH4+, Porque os três grupos etílicos doam parte de sua densidade eletrônica para reduzir a carga positiva no átomo de nitrogênio; Portanto, a trietilamina é mais básica que a amônia (mas menos básica que oh-).
Formulários
 Reações catalisadas por trietilamina. Fonte: Tachymètre [domínio público].
Reações catalisadas por trietilamina. Fonte: Tachymètre [domínio público]. Basicicidade, neste caso, a nucleofilicidade da trietilamina é usada para catalisar a síntese de éster e amidas de um substrato comum: um cloreto de acil, rcocl (imagem superior).
Aqui, o par livre de elétrons de nitrogênio ataca o grupo carbonil, formando um intermediário; que, consecutivamente, é atacado por um álcool ou uma amina para formar um éster ou amida, respectivamente.
Na primeira linha da imagem, o mecanismo que segue a reação para produzir o éster é visualizado, enquanto a segunda linha corresponde à amida. Observe que nas duas reações ocorre o cloridrato de trietilamina, líquido3· HCl, do qual o catalisador é recuperado para iniciar outro ciclo.
Polímeros
A nucleofilicidade da trietilamina também é usada para adicionar certos polímeros, curando -os e dando -lhes maiores massas. Por exemplo, faz parte da síntese de resinas policarbonadas, espumas de poliuretano e resinas epóxi.
Cromatografia
Sua anfifilicidade e volatilidade remotas permitem que seus sais derivados sejam usados como reagentes na cromatografia em troca iônica. Outro uso implícito de trietilemina é que vários sais de aminas terciárias podem ser obtidas a partir dela, como bicarbonato de trietilamina, NHET3HCO3 (ou TEAB).
Pode atendê -lo: calorimetria: quais estudos e aplicaçõesProdutos comerciais
Foi usado como aditivo na formulação de cigarros e tabaco, conservantes de alimentos, pisos, aromatizantes, pesticidas, corantes, etc.
Riscos
Os vapores da trietilamina não são apenas desagradáveis, mas perigosos, pois podem irritar o nariz, a garganta e os pulmões para causar edema pulmonar ou bronquite. Da mesma forma, sendo mais denso e pesado que o ar, eles permanecem no nível do solo, passando para possíveis fontes de calor para explodir posteriormente.
Os recipientes deste líquido devem estar o mais longe do fogo, porque representam um perigo iminente de explosão.
Além disso, contato com espécies ou reagentes como: metais alcalinos, ácido tricloroacético, nitratos, ácido nítrico (como formaria nitrosoaminas, compostos carcinogênicos), ácidos fortes, peróxidos e permanganatos.
Você não deve tocar em alumínio, cobre, zinco ou suas ligas, pois tem a capacidade de corroer -las.
Em relação ao contato físico, pode causar alergia e erupções cutâneas se a exposição for aguda. Além dos pulmões, isso pode afetar o fígado e os rins. E em relação ao contato ocular, causa irritação, o que pode até danificar os olhos se não forem tratados ou limpos no tempo.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.
- Wikipedia. (2019). Trietilamina. Recuperado de: em.Wikipedia.org
- Merck. (2019). Trietilamina. Recuperado de: Sigmaaldrich.com
- Centro Nacional de Informações sobre Biotecnologia. (2019). Trietilamina. Banco de dados PubChem. CID = 8471. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Rede de dados de toxicologia. (s.F.). Trietilamina. Recuperado de: toxnet.Nlm.NIH.Gov
- Departamento de Saúde de Nova Jersey. (2010). Trietilamina. Recuperado de: NJ.Gov
- « 10 curiosidades sobre a Idade Média que o surpreenderão
- Estrutura Alcoólica Isoamilica, Propriedades, Usos e Riscos »

