Agência de sulfito de bismuto, preparação e usos
- 927
- 112
- Melvin Mueller
Ele Agar de sulfito de bismuto É um meio de cultura sólida, seletiva e diferencial, especialmente formulada para o isolamento de Salmonella enterica subgrupo enterica typhi seretypo, Entre outras espécies de Salmonella. O ambiente é conhecido como BSA concorda em ágar inglês de sulfito de bismuto.
A fórmula original do ágar sulfita de bismuto foi criada em 1927 por Wilson e Blair (meio de ferro sulfito de bismuto de glicose); Isso continha sulfito de sódio, glicose, solução de bismuto, citrato de amônio, sulfato ferroso e adição de ágar.
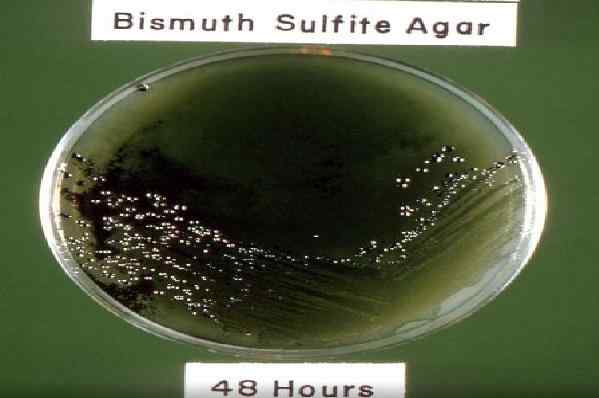
 48 -HOLE CRESCIMENTO DE SALMONELLA SP INCUBAÇÃO EM BISMUTH SULFITE AGAR. Fonte: Pixnio.com autor: dr. C. R. Erving, USCDCP
48 -HOLE CRESCIMENTO DE SALMONELLA SP INCUBAÇÃO EM BISMUTH SULFITE AGAR. Fonte: Pixnio.com autor: dr. C. R. Erving, USCDCP Atualmente, há uma modificação do meio original, composto de extrato de carne, peptonos de carne e caseína, indicador de sulfito de bismuto, glicose, fosfato de dissódio, sulfato ferroso, verde brilhante e ágar-ágar.
Existem muitos meios para o isolamento de espécies de Salmonella, mas quando se trata de recuperar o sorotipo Typhi, o ágar sulfito de bismuto apresenta uma vantagem notável sobre eles, uma vez que na maioria uma recuperação muito baixa ou zero desse microorganismo é obtida.
No entanto, é necessário usar mais de um tipo de meio quando se trata de isolar enteropatogênico, porque o ágar sulfito de bismuto é menos eficaz para outras espécies de Salmonella e para o gênero Shigella, que são inibidos ou se desenvolvem muito mal neste ágar.
Deve -se notar que, de todas as espécies de Salmonella, o sorotipo Typhi é um dos enteropatógenos mais importantes do humano, sendo este seu único reservatório. Esta sorovariedade produz febre tifóide, gastroenterite, bacteremia e septicemia.
Por esse motivo, é relevante incluir este ágar quando amostras de água, fezes ou alimentos são analisadas onde sua presença é suspeita.
[TOC]
Base
Como a maioria dos meios de cultivo, o ágar sulfito de bismuto contém substâncias nutricionais para promover o desenvolvimento bacteriano, como peptones e extrato de carne. Da mesma forma, a glicose funciona como fonte de energia e carbono.
Pode atendê -lo: elementos biogenéticosAgora, nem todas as bactérias crescerão neste meio, já que o ágar sulfito de bismuto é um meio seletivo. Isso contém compostos que inibem o crescimento de microorganismos Gram positivos e certas bactérias gram -negativas. Esses compostos são: o indicador de sulfito de bismuto e verde brilhante.
Por outro lado, o fosfato dissódico mantém a osmolaridade e o pH do meio.
Além disso, o ágar sulfito de bismuto é um meio diferencial graças à presença de sulfato ferroso, que mostra a formação de H2S. O h2S formado por bactérias reagem com sulfato ferroso e forma um precipitado insolúvel claramente visível.
Finalmente, o Agar -gar oferece consistência sólida ao meio ambiente.
Preparação
Pesar 52,3 gr do meio desidratado e dissolver -se em um litro de água. Aqueça para ferver a mistura por 1 minuto com agitação frequente, até sua dissolução total. Não superaqueça muito. Este meio não é esterilizado em autoclave, porque o calor extremo danifica o meio de cultura.
Deixe esfriar a 45 ° C e tremer antes de servir em placas estéreis de Petri. Recomenda -se fazer pratos com boa espessura. Para isso, 25 ml devem ser derramados em cada placa. Deixe solidificar. Como é um meio que não é esterilizado, é normal que seu uso imediato seja sugerido.
No entanto, um estudo de D'Aust em 1977 mostrou que há uma melhor recuperação de Salmonella typhimurium e Salmonella enteritidis À medida que o meio de sulfito de bismuto é envelhecido, o desempenho dos sorovários não é afetado Typhi e Parathyphi b.
D'Aous recomenda o uso das placas para o dia 4 do resfriamento, embora alerte que, à medida que o meio envelhece a seletividade diminui, desenvolvendo mais facilmente tensões de Proteus vulgaris.
É por isso que, para amostras muito poluídas, como fezes, é preferível usar o meio recém -preparado. Caso contrário, use no dia 4 de sua preparação. Outros autores recomendam o uso das placas no dia seguinte à sua preparação, armazenada em refrigeração.
Pode servir a você: Uracil: estrutura, funções, propriedades, síntesePlacas refrigeradas devem ser temperadas antes de usar. O pH médio deve ser de 7,5 ± 0,2. A cor do meio não remunerado é bege e preparado é opalento cinza esverdeado.
Formulários
Entre as amostras que podem ser semeadas neste meio estão amostras de fezes, águas de consumo ou comida e comida.
Para melhorar os isolados, é recomendável realizar um tratamento pré-enriquecimento com caldo de lactose e após o enriquecimento com caldo de tetracionato ou cistina de caldo de selenito, antes de semear em ágar sulfito de bismuto.
As placas são incubadas a 35 ° C ± 0,2 por 24 a 48 horas, em aerobiose.
Características das colônias em ágar sulfito de bismuto
As colônias de Salmonella typhi Eles geralmente são vistos neste ágar em 24 horas com um centro preto e cercado por um halo verde brilhante. Enquanto, em 48 horas, o preto gira completamente devido à formação de sulfeto de hidrogênio.
Salmonella parathyphi a apresenta colônias com características variáveis. Após 18 horas de incubação, colônias pretas, verdes ou transparentes podem ser observadas, com aparência mucóide. Enquanto, às 48 horas, eles são observados completamente pretos e às vezes com um brilho metálico pronunciado.
S. Parathyphi a Tende a espalhar o meio ao redor da colônia.
Salmonella sp Black ou Grayercolonias Grounds, com ou sem brilho metálico, Maying se torna a superfície ou não.
As cepas coliformes, geralmente, são totalmente inibidas, mas se crescem, se desenvolvem como colônias verdes ou marrons opacas e brilho metálico. Não tinge o meio ao redor da colônia.
Limitação
-Inóculos muito fracos podem causar colônias de Salmonella typhi verde claro, passando despercebido e relatando a cultura como negativa.
Pode atendê -lo: ramos da fisiologia- Agar de sulfito de bismuto pode inibir a recuperação de algumas espécies de Salmonella, como S. Sendai, s. Berta, s. Gallinarum, s. Abortus-Equi.
-Este meio inibe a maioria das espécies do gênero Shigella.
- S. Typhi e S. Arizonae Eles podem dar colônias muito semelhantes.
-Os coliformes produzidos por H2S como Proteus e Citrobacter produzem colônias semelhantes às de Salmonella, por isso é necessário realizar testes de identificação bioquímica.
-Uma boa estria deve ser feita para obter colônias isoladas; É a única maneira de observar as características típicas das colônias do gênero Salmonella.
Controle de qualidade
Para o controle da esterilidade, uma placa é incubada sem inocular a 37 ° C, espera -se que não haja crescimento ou mudança de cor.
Para controle de qualidade, você pode semear cepas conhecidas, como:
Escherichia coli ATCC 25922, Salmonella enteritidis ATCC 13076, Salmonella typhi ATCC 19430, Shigella Flexneri ATCC 12022, Enterococcus faecalis ATCC 29212.
Espera-se que Escherichia coli e Shigella Flexneri são parcialmente inibidos em desenvolvimento de colônias marrom esverdeadas e marrons, respectivamente. Enquanto os dois Salmonglars devem ter um excelente desenvolvimento com colônias negras com brilho metálico e finalmente Enterococcus faecalis deve ser totalmente inibido.
Referências
- Wilson, w., & E. M. MCV. Blair. Uso de um meio de ferro sulfito de bismuto de glicose para o isolamento de B. Tifoso e B. Proteus. O Journal of Hygiene, 1927; 26(4), 374-391. Recuperado de .Jstor.org
- D'Aust JY. Efeito das condições de armazenamento do desempenho do ágar de sulfito de bismuto. J Clin Microbiol. 1977; 5 (2): 122-124. Disponível em: NCBI.Nlm.NIH.Gov
- Laboratórios IVD. Ágar bismuto-sulfito de acordo com Wilson-Blair. 2009. Disponível em: bismuthsulfitagar_span_jan_2009%20 (2).Pdf
- Laboratórios da Himedia. Agar de sulfito de bismuto. 2017. Disponível em: Himediabs.com
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico microbiológico de Bailey & Scott. 12 ed. Pan -American Editorial S.PARA. Argentina.
- Morales R, de La Cruz D, Leyva G e Ybarra M. Qualidade bacteriológica do leite de cabra cru produzido em Miravalles, Puebla. Rev Mex de Ing Chem 2012; 11 (1): 45-54
- « Farinha de milho. Fundação, preparação e uso
- William James Sidis, o homem mais inteligente da história? »

