Estrutura de iodeto de chumbo, propriedades, obtenção, usa

- 1340
- 90
- Ralph Kohler
Ele Chumbo iodeto É um composto inorgânico formado pelo elemento principal (PB) em sua oxidação +2 e iodo (i) com Valencia -1. Sua fórmula química é PIB2. É um composto tóxico. Porque é liderar é prejudicial ao ser humano, animais e ecossistemas naturais. Além disso, o iodeto também pode causar algumas doenças.
O composto do PIB4, Isso é, com chumbo na oxidação +4, parece que não existe, provavelmente devido à capacidade de redução do íons iodeto (i-). O PIB2 É uma cor amarela sólida solúvel em água.
 Iodeto de chumbo (PIB2) sólido. C. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Iodeto de chumbo (PIB2) sólido. C. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. Pode ser obtido usando uma reação de troca iônica entre um sal de iodeto e um chumbo que são solúveis na água.
Possui propriedades semicondutores; portanto, a maioria de suas aplicações atuais está em dispositivos fotovoltaicos, detectores de certos radiação e sensores.
Um dos usos mais estudados desse composto é o das células solares perovskita, que provaram ser muito eficientes e de baixo custo.
[TOC]
Estrutura
No iodeto de chumbo, a união entre seus átomos é iônica apenas em parte. Os átomos formam camadas com estrutura hexagonal e estão ligados entre si por meio de forças fracas de van der Waals.
Essas forças não são iônicas nem covalentes, são interações fracas entre as camadas eletrônicas de átomos.
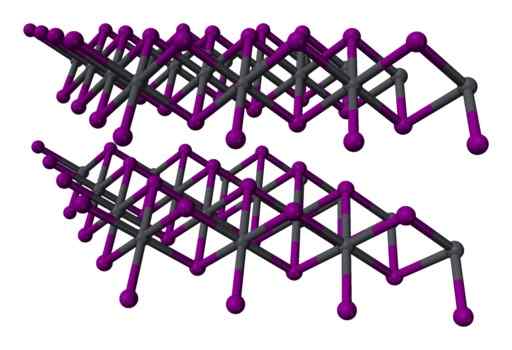 Two -jogador de três camadas de três camadas2 cristalino. Cinza = chumbo; Violeta = iodo. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons.
Two -jogador de três camadas de três camadas2 cristalino. Cinza = chumbo; Violeta = iodo. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons. Nomenclatura
- Chumbo iodeto
- Iodeto de chumbo (ii)
- Diyoduro principal
- Iodeto de plumboso
Propriedades
Estado físico
Sólido cristalino amarelo brilhante. Cristais hexagonais.
 Cristais hexagonais de iodeto de chumbo. Alessandro E Damiano/CC por (https: // CreativeCommons.Org/licenças/por/4.0). Fonte: Wikimedia Commons.
Cristais hexagonais de iodeto de chumbo. Alessandro E Damiano/CC por (https: // CreativeCommons.Org/licenças/por/4.0). Fonte: Wikimedia Commons. Peso molecular
461 g/mol
Ponto de fusão
410 ºC
Ponto de ebulição
954 ° C, ferva com decomposição.
Densidade
6.16 g/cm3
Solubilidade
Levemente solúvel em água: 0,076 g/100 ml a 25 ° C. Água quente solúvel. Insolúvel em álcool e ácido clorídrico frio (HCl).
Pode atendê -lo: sódio: história, estrutura, propriedades, riscos e usosPropriedades quimicas
Suas propriedades oxidantes e redutoras são fracas. No entanto, você pode apresentar reações de oxidenção.
Embora seja muito pouco solúvel em água se dissolve em soluções concentradas de iodetos alcalinos, como iodeto de potássio (KI). É solúvel em solução concentrada de acetato de sódio (CH3Bolso). Ele se dissolve livremente em solução de tiossulfato de sódio (NA2S2QUALQUER3).
Alguns autores indicam que na água o ION PBI pode ser gerado+ E se houver excesso de íons de íons (eu-) espécies mais complexas, como o PIB, podem ser formadas3- e PIB42-, entre outras.
Não é inflamável.
Outras propriedades físicas
Ele se comporta como um semicondutor, isto é, que pode ou não conduzir eletricidade, dependendo das condições às quais é submetida.
É um semicondutor de gap direto, isto é, para um de seus elétrons passar da banda de Valência para dirigir, ele deve ter apenas uma quantidade de energia igual à largura de banda proibida.
Devido ao alto número atômico de seus elementos (Pb = 82, i = 53), ele tem uma alta capacidade fotoelétrica. Sua banda de 2,5 gap permite performances fotovoltaicas de alta eficiência a temperaturas de até 250 ° C.
Obtenção
Pode ser preparado reagindo um composto solúvel em água com ácido iarídico (HI) ou com um iodeto de metal solúvel. Por exemplo, uma solução aquosa de acetato de chumbo com iodeto de potássio é mista:
PB (cap3COO)2 + 2 KI → PIB2↓ + 2 K (escolha3COO)
Esse tipo de reação é conhecido como "troca de íons" porque cátions e ânions são trocados entre sais.
No exemplo mencionado, o acetato de potássio é muito solúvel em água e permanece dissolvido, enquanto iodeto de potássio, sendo menos solúvel, precipitado e filtro. A purificação é feita recristalizando o composto na água.
Pode atendê -lo: cristalizaçãoPrecipitação do PBI2 Pode ser visto na imagem a seguir que mostra um tubo de ensaio onde o nitrato de chumbo (ii) (pb (não3)2) e iodeto de potássio (KI) em solução aquosa. Este efeito é chamado de "ouro do ouro".
 Chuva de ouro do PIB2. Stefano SCT/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Chuva de ouro do PIB2. Stefano SCT/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Formulários
Como semicondutor
É usado como detector para fótons de alta energia, como raios X e raios gama. Pode ser usado em dispositivos fotovoltaicos, fotocélulas, luzes LED, detectores ópticos e em classificação e sensores biológicos.
Se introduzido em nanoestruturas, ele pode ser usado em fotocatálise e células solares. Além disso, muitas nanopartículas do PIB2 Eles têm propriedades luminescentes.
 O iodeto de chumbo é usado em detectores médicos de raio x. Autor: lkcjjang40090. Fonte: Pixabay.
O iodeto de chumbo é usado em detectores médicos de raio x. Autor: lkcjjang40090. Fonte: Pixabay. Células solares
O PIB2 É um intermediário na síntese de perovskitas destinados a células solares. Este tipo de células fotovoltaicas contém metilamônio e iodeto de chumbo (escolha3NH3PIB3) Com base no tio2.
Esses dispositivos têm alta eficiência e baixo custo, por isso foram muito estudos e pesquisas.
 Células solares no telhado de uma casa no campo. As células solares nas quais o PBI é usado2 Eles são muito eficientes e não são muito caros, para que possam ser usados em casas no futuro. Autor: Manfred Antranias Zimmer. Fonte: Pixabay.
Células solares no telhado de uma casa no campo. As células solares nas quais o PBI é usado2 Eles são muito eficientes e não são muito caros, para que possam ser usados em casas no futuro. Autor: Manfred Antranias Zimmer. Fonte: Pixabay. No entanto, desde Cho3NH3PIB3 Ele pode quebrar com a água da chuva, foi estudado como poluir essas células podem ser ambas quando estão em uso e quando descartadas.
O ch3NH3PIB3 Após o contato com a água, ela se transforma em metilamina (escolha3NH2), Ácido yodhydric e PIB2. O último, embora seja pouco solúvel em água, com o tempo pode liberar quantidades do Ion Toxic PB2+.
Os estudos não são conclusivos, porque o local onde a liberação de chumbo ocorre para determinar se a quantidade pode ser prejudicial no curto prazo. Por outro lado, uma liberação contínua pode bioacumular e ser muito perigosa.
Pode atendê -lo: butanona: estrutura, propriedades e usosOutros aplicativos
- É semeado na forma de spray nas nuvens para produzir chuva.
- Em filtros para astronomia do infravermelho distante.
- Na fotografia, impressões, filmes para gravar imagens ópticas, emulsões fotográficas.
- No revestimento do freio. Em gorduras lubrificantes.
- Lâmpadas de arco a vapor de mercúrio. Em papel eletrótico.
- Materiais termoelétricos, baterias térmicas com iodo.
Riscos
Para segurança
Deve ser armazenado longe de oxidantes, como peróxidos, peróxidos, permanganatos, cloros e nitratos. Contato com metais quimicamente ativos, como potássio, sódio, magnésio e zinco, também devem ser evitados. Em todos esses casos, uma reação violenta pode ocorrer.
Se você sofrer aquecimento, gases venenosos de chumbo e iodo são gerados.
Para a saúde
É muito prejudicial ao ser humano. Foi confirmado que é carcinogênio para animais, portanto, é razoavelmente deduzido que também é para o ser humano.
Pode causar dor de cabeça, irritabilidade, reduzir a memória e perturbar o sono. O chumbo contido neste composto pode gerar danos permanentes aos rins, cérebro, nervos, células sanguíneas e alto risco de pressão.
Deve ser tratado como um teratogênio (composto que pode gerar um defeito congênito). Também pode produzir iodismo, cujos sintomas são congestionamentos de narinas, dor de cabeça, irritação de membranas mucosas e erupção cutânea, entre outros.
Para o ambiente natural
É classificado como poluente tóxico. Deve ser mantido longe da água e fontes de drenagem. Para evitar que contaminar diques devem ser construídos sempre que for necessário retê -lo.
É muito tóxico para a vida aquática com efeitos que duram ao longo do tempo, pois é bioacumulável.
Referências
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- OU.S. Biblioteca Nacional de Medicina. (2019). Chumbo iodeto. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Evstropiev; S.K. et al. (2020). Síntese e caracterização de PVP/PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Link recuperado.Springer.com.
- Ismail, r.PARA. et al. (2016). Síntese de PBI2 Nanopartículas por ablação a laser em metanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Link recuperado.Springer.com.
- Materiais. (2013). Iodeto de chumbo (PIB2) Semicondutor. Recuperado de Azom.com.
- CDH (2008). Chumbo (ii) iodeto. Material da folha de dados de segurança. Recuperado de chdfinechemical.com.
- HAILEGNAW, b. et al. (2015). Chuva no metilamônio chumbo em iodeto perovskitas: possíveis efeitos ambientais de células solares de perovskita. J. Phys. Chem. Lett. 2015, 6, 9, 1543-1547. Recuperado de bares.ACS.org.
- Fundação Wikimedia (2020). Chumbo (ii) iodeto. Recuperado de.Wikipedia.org.
- « Estrutura de acetato de chumbo, propriedades, obtenção, usa
- Organização de uma empresa objetiva, estrutura, exemplo »

