Óxido de ouro (iii) (Au2O3) O que é, estrutura, propriedades, usa
- 2991
- 593
- Shawn Leffler
Ele óxido de ouro (III) É um composto inorgânico cuja fórmula química é au2QUALQUER3. Teoricamente, sua natureza poderia ser esperada fora do tipo covalente. No entanto, a presença de um certo caráter iônico em seu sólido não pode ser totalmente descartado; ou o que é o mesmo, suponha a ausência da ação3+ próximo ao ânion ou2-.
Pode parecer contraditório que o ouro, sendo um metal nobre, possa oxidar. Em condições normais, as peças de ouro não podem oxidar por contato com o oxigênio da atmosfera; No entanto, quando são irradiados com radiação ultravioleta na presença de ozônio, ou3, O panorama é outro.
Se as estrelas do ouro sofrerem essas condições, elas se tornariam uma cor marrom avermelhada, característica da Au2QUALQUER3.
Outros métodos para obter esse óxido implicariam o tratamento químico dessas estrelas; Por exemplo, transformando a massa de ouro em seu respectivo cloreto, AUCL3.
Então para o AUCL3, E o restante dos possíveis sais de ouro formados, um meio básico forte é adicionado; E com isso, é obtido óxido hidratado ou hidróxido, Au (OH)3. Finalmente, o último composto é desidratado termicamente para obter a Au2QUALQUER3.
Estrutura de óxido de ouro (iii)
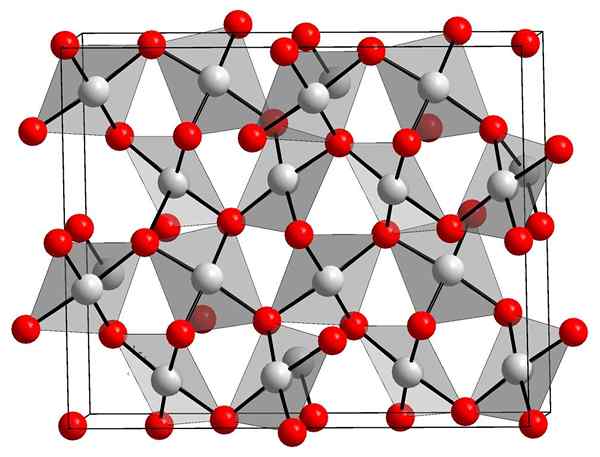
 Estrutura cristalina de óxido de ouro. Orci, Wikimedia Commons.
Estrutura cristalina de óxido de ouro. Orci, Wikimedia Commons. A imagem superior mostra a estrutura cristalina do óxido de ouro (iii). A disposição de átomos de ouro e oxigênio no sólido é mostrada, considerando átomos neutros (sólido covalente) ou íons (sólido iônico). De forma intercambiável, apenas elimine ou coloque os links de AU-O em qualquer caso.
De acordo com a imagem, supõe -se que o caráter covalente predomina (que seria lógico). Por esse motivo, os átomos e links representados com esferas e barras são mostrados, respectivamente. Esferas brancas correspondem a átomos de ouro (AUIii-O) e os átomos avermelhados de oxigênio.
Pode atendê -lo: hidroxiapatitaSe observado com cuidado, será visto que existem unidades AUO4, que se ligam por átomos de oxigênio. Outra maneira de visualizar seria considerar que cada au3+ é cercado por quatro ou2-; Claro, de uma perspectiva iônica.
Essa estrutura é cristalina porque os átomos são ordenados obedecendo ao mesmo padrão de longa faixa. Assim, sua célula unitária corresponde ao sistema cristalino romboédrico (o mesmo que a imagem superior). Portanto, tudo Au2QUALQUER3 Pode ser construído se todas as esferas da célula unitária fossem distribuídas no espaço.
Aspectos eletrônicos
O ouro é um metal de transição e espera. Essa sobreposição de seus orbitais teoricamente deve gerar bandas de direção, o que faria a au2QUALQUER3 Em um semicondutor sólido.
Portanto, a verdadeira estrutura da Au2QUALQUER3 é ainda mais complexo ter isso em mente.
Hidrata
O óxido de ouro pode reter moléculas de água dentro de seus cristais romboédicanos, o que dá origem a hidratos. Quando esses hidratos são formados, a estrutura se torna amorfa, ou seja, desordenada.
A fórmula química para tais hidratos pode ser qualquer um dos seguintes, que de fato não são profundamente esclarecidos: au2QUALQUER3∙ Zh2O (z = 1, 2, 3, etc.), Au (oh)3, ou auxQUALQUERe(OH)z.
A fórmula Au (OH)3 representa uma simplificação da verdadeira composição desses hidratos. Isso ocorre porque dentro do hidróxido de ouro (iii), os pesquisadores também encontraram a presença de Au2QUALQUER3; E, portanto, perde significado para tratá -lo isoladamente como um hidróxido de metal de transição "simples".
Pode atendê-lo: equilíbrio de vapor líquidoPor outro lado, de uma fórmula sólida com AuxQUALQUERe(OH)z Uma estrutura amorfa poderia ser esperada; já que isso depende dos coeficientes x, e e z, cujas variações resultariam em todos os tipos de estrutura que dificilmente poderiam exibir um padrão cristalino.
Propriedades
Aparência física
É um sólido marrom avermelhado.
Massa molecular
441,93 g/mol.
Densidade
11,34 g/ml.
Ponto de fusão
Derrete e se decompõe a 160ºC. Falta um ponto de ebulição, então esse óxido nunca ferve.
Estabilidade
Au2QUALQUER3 É termodinamicamente instável porque, como mencionado no início, o ouro não tende a oxidar em condições de temperatura normal. Para que seja facilmente reduzido para se tornar o ouro nobre.
Quanto maior a temperatura, mais rápida será essa reação, que é conhecida como decomposição térmica. Assim, a au2QUALQUER3 A 160ºC, ele se decompõe para produzir ouro metálico e liberar oxigênio molecular:
2 au2QUALQUER3 => 4 au + 3 o2
Uma reação muito semelhante pode ocorrer com outros compostos que favorecem essa redução. Por que redução? Porque o ouro ganha os elétrons que o oxigênio removeu; O que é o mesmo que perder links para oxigênio.
Solubilidade
É um sólido insolúvel em água. No entanto, é solúvel em ácido clorídrico e ácido nítrico, devido à formação de cloretos de ouro e nitratos.
Nomenclatura
O óxido de ouro (III) é o nome governado pela nomenclatura de ações. Outras maneiras de mencionar são:
-Nomenclatura tradicional: óxido aurico, porque o Valencia 3+ é o maior para o ouro.
-Nomenclatura sistemática: trióxido de Diorro.
Formulários
Coloração de vidro
Um de seus usos mais eminentes é fornecer cor avermelhada a certos materiais, como óculos, além de conferir certas propriedades inerentes a átomos de ouro.
Pode atendê -lo: brometo de hidrogênio (HBR)Síntese de aurados e ouro fulminante
Se a Au for adicionada2QUALQUER3 Para um meio onde é solúvel e, na presença de metais, pode precipitar após a adição de uma base forte, os aurados; que são formados por ânions AUO4- Na companhia de cátions de metal.
Além disso, a au2QUALQUER3 reage com amônia para formar o composto de ouro fulminante, au2QUALQUER3(NH3)4. Seu nome deriva do fato de ser altamente explosivo.
Manipulação de monocapas auto -montada
Em ouro e seu óxido, certos compostos não são adsorvidos da mesma maneira, como Disulfur Dialil, RSSR. Quando essa adsorção ocorre, uma ligação Au-S é formada espontaneamente, onde o átomo de enxofre exibe e define as características químicas da referida superfície, dependendo do grupo funcional ao qual está ligado.
O RSSR não pode ser adsorvido sobre Au2QUALQUER3, Mas sobre ouro metálico. Portanto, se a superfície do ouro e seu grau de oxidação são modificados, bem como o tamanho das partículas ou camadas de Au2QUALQUER3, Uma superfície mais heterogênea pode ser projetada.
Esta superfície Au2QUALQUER3-Ausr interage com óxidos metálicos de certos dispositivos eletrônicos, desenvolvendo futuras superfícies mais inteligentes.
Referências
- Óxidos de ouro. Recuperado de: 911Metallurgist.com
- Shi, r. Asahi e c. Stampfl. (2007). Propriedades dos óxidos de ouro au2QUALQUER3 e au2O: pesquisa de primeiros princípios. A Sociedade Física Americana.
- « Chigualca o que é, características, habitat, usos, propriedades
- Hemidesmossomos O que é, descrição, estrutura, funções »

