Estrutura de óxido de fósforo (v), propriedades, obtenção, uso, riscos

- 1901
- 82
- Terrence King IV
Ele Óxido de fósforo (V) É um sólido inorgânico formado por fósforo (P) e oxigênio (O). Sua fórmula empírica é p2QUALQUER5, enquanto sua fórmula molecular correta é P4QUALQUER10. É um sólido branco muito higroscópico, ou seja, pode absorver o ar do ar com muita facilidade, reagindo imediatamente com isso. A reação pode ser perigosa porque causa um rápido aumento de temperatura.
Sua alta tendência a absorver a água fez com que ela fosse usada como agente de secagem em laboratórios químicos, bem como desidratando alguns compostos, isto é, para eliminar a água de suas moléculas.
 Óxido de fósforo (V) em pó, P4QUALQUER10. LHCHEM [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Óxido de fósforo (V) em pó, P4QUALQUER10. LHCHEM [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. O óxido de fósforo (V) também é usado para acelerar as reações de ligação de moléculas de vários hidrocarbonetos, sendo uma reação chamada condensação. Além disso, permite converter certos ácidos orgânicos em ésteres.
Foi usado, por exemplo, para refinar a gasolina, para preparar o ácido fosfórico H3Po4, Para obter compostos que servem para atrasar o fogo, fabricar vidro para aplicações a vácuo, entre muitos outros usos.
O óxido de fósforo (V) deve ser mantido em recipientes bem fechados para evitar o contato com a umidade do ar. É corrosivo e pode prejudicar os olhos, pele e muco.
[TOC]
Estrutura
O óxido de fósforo (V) é formado por fósforo (P) e oxigênio (O), onde o fósforo tem valência de +5 e oxigênio -2. A molécula de óxido de fósforo (V) possui quatro átomos de fósforo e dez oxigênio e é por isso que sua fórmula molecular correta é p é p4QUALQUER10.
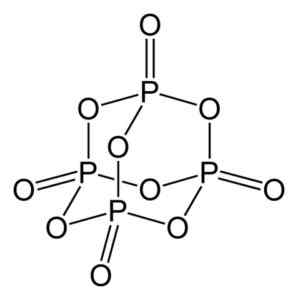 Estrutura da molécula de óxido de fósforo (V), P4QUALQUER10. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Estrutura da molécula de óxido de fósforo (V), P4QUALQUER10. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. Existe em três formas cristalinas, como poeira amorfa e de forma vítrea (como vidro). Na forma cristalina hexagonal, cada um dos átomos de fósforo é encontrado nos vértices de um tetraedro.
Nomenclatura
- Óxido de fósforo (V)
- Pentóxido de fósforo
- Pentóxido difosfaco
Pode atendê -lo: solvente: conceito, tipos e exemplos- Pentóxido fosfórico
- Anidrido fosfórico
- Decaimento do tetraforus
Propriedades
Estado físico
Sólido branco cristalino. A forma mais comum é a dos cristais hexagonais.
Peso molecular
283,89 g/mol
Ponto de fusão
562 ºC
Temperatura da sublimação
360 ºC a 1 Atmosfera de pressão. Isso significa que a essa temperatura passa do gás sólido sem passar pelo estado líquido.
Densidade
2,30 g/cm3
Solubilidade
Muito solúvel em água. Ácido sulfúrico solúvel. Insolúvel em acetona e amônia.
Propriedades quimicas
O óxido de fósforo (V) absorve e reage com o ar do ar com extremo formando rapidamente o ácido fosfórico H3Po4. Esta reação é exotérmica, o que significa que o calor é produzido durante o mesmo.
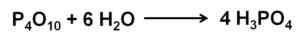 Reação de óxido de fósforo (v) com água para formar ácido fosfórico H3Po4. Autor: Marilú Stea.
Reação de óxido de fósforo (v) com água para formar ácido fosfórico H3Po4. Autor: Marilú Stea. A reação de P4QUALQUER10 com a água leva à formação de uma mistura de ácidos fosfóricos cuja composição depende da quantidade de água e condições.
A reação com álcoois leva à formação de ácido fosfórico ou ésteres de ácido polimérico, dependendo das condições experimentais.
P4QUALQUER10 + 6 ROH → 2 (RO)2Po.Oh + 2 ro.Po (oh)2
Com óxidos básicos formam fosfatos sólidos.
É corrosivo. Pode reagir perigosamente com ácido fórmico e bases inorgânicas, como hidróxido de sódio (NaOH), óxido de cálcio (CaO) ou carbonato de sódio Na2Co3.
Se uma solução de ácido perclórico HCLO for derramado4 e Chcl Chlorofórmio3 Em óxido de fósforo (v) p4QUALQUER10 Uma explosão violenta ocorre.
Outras propriedades
Não é inflamável. Não favorece a combustão. No entanto, sua reação da água é tão violenta e exotérmica que pode haver um risco de incêndio.
Obtenção
Pode ser preparado por oxidação direta de fósforo em uma corrente de ar seca. Fósforo quando o contato com excesso de oxigênio é oxidado formando óxido de fósforo (V).
P4 + 5 o2 → p4QUALQUER10
Presença na natureza
O óxido de fósforo (V) é encontrado em minerais como ilmenita, rutilo e zircón.
Pode atendê -lo: o que são funções químicas inorgânicas?A ilmenita é um mineral que contém ferro e titânio e às vezes possui óxido de fósforo (v) em concentrações que variam entre 0,04 e 0,33% em peso. Rutilo é um mineral de óxido de titânio e pode conter cerca de 0,02% em peso de P2QUALQUER5.
Areias de zircón (um mineral de elemento de zircônio) têm óxido de fósforo (V) a 0,05-0,39% em peso.
Formulários
Como um agente desidratante e secante
Devido à sua grande avidez para a água, é um dos agentes desidratados mais conhecidos e muito eficazes a temperaturas menores que 100 ° C.
Pode extrair água de substâncias que são consideradas agentes desidratantes. Por exemplo, você pode remover a água do ácido sulfúrico H2SW4 fazendo isso3 e ácido nítrico hno3 transformando -o em n2QUALQUER5.
 Desidratação do ácido sulfúrico devido ao óxido de fósforo (V). Autor: Marilú Stea.
Desidratação do ácido sulfúrico devido ao óxido de fósforo (V). Autor: Marilú Stea. Basicamente.
Em reações químicas orgânicas
O óxido de fósforo (V) serve para fechar anéis de compostos orgânicos e outras reações de condensação.
Permite esterificar os ácidos orgânicos com a possibilidade de distinguir entre ácidos carboxílicos alifáticos primários (cadeia carbonatada sem anéis com o grupo -cooh em uma extremidade) e os ácidos aromáticos (grupo -coh ligado ao anel benzeno), pois os últimos não reagem.
Também serve para eliminar uma molécula H2Ou do amidas r (c = o) NH2 E isso os torna nitriles R-CN. Além disso, catalisar ou acelerar a oxigenação, desidrogenação e polimerização de reações de betume.
 O p4QUALQUER10 É amplamente utilizado em laboratórios de química orgânica. Autor: JDN2001CN0. Fonte: Pixabay.
O p4QUALQUER10 É amplamente utilizado em laboratórios de química orgânica. Autor: JDN2001CN0. Fonte: Pixabay. Em refino de combustível
Desde a década de 1930 do século XX, certos estudos indicaram que o óxido de fósforo (v) exerceu uma ação de refino de gás, aumentando seu octano.
A ação de refino de P4QUALQUER10 É principalmente devido a reações de condensação (união de diferentes moléculas) e não de polimerização (ligação de moléculas iguais).
Pode atendê -lo: acetato de sódio: estrutura, propriedades, síntese, usosO p4QUALQUER10 Acelera os hidrocarbonetos alomáticos diretos com hidrocarbonetos de olefina, conversão de olefina em naftens e polimerização parcial. A reação de alquilação aumenta o número de octanas de gasolina.
Dessa maneira, uma gasolina refinada de alta qualidade é obtida.
 Alguns derivados de petróleo podem ser melhorados pela ação de P4QUALQUER10 Em suas moléculas. Autor: DRPEPERSCOTT230. Fonte: Pixabay.
Alguns derivados de petróleo podem ser melhorados pela ação de P4QUALQUER10 Em suas moléculas. Autor: DRPEPERSCOTT230. Fonte: Pixabay. Em várias aplicações
O óxido de fósforo (V) serve:
- Prepare o ácido fosfórico H3Po4
- Obter ésteres de acrilato e surfactante
- Prepare ésteres de fosfato usados como retardadores de chama, solventes e diluentes
- Conversão de tricloreto de fósforo em oxicloreto de fósforo
- Reagente de laboratório
- Fabrica óculos especiais para tubos de vácuo
- Aumentar o ponto de fusão do asfalto
- Sirva como uma molécula padrão na determinação de fósforo ou fosfatos em rochas fosfáticas, fertilizantes e cimento Portland, na forma de P2QUALQUER5
- Melhorar os vínculos entre certos polímeros e a camada de marfim que os dentes possuem
 Alguns óculos especiais, como tubos de vácuo, precisam usar P4QUALQUER10 durante sua fabricação. Tvezymer [domínio público]. Fonte: Wikimedia Commons.
Alguns óculos especiais, como tubos de vácuo, precisam usar P4QUALQUER10 durante sua fabricação. Tvezymer [domínio público]. Fonte: Wikimedia Commons. Riscos
O óxido de fósforo (V) deve ser mantido em recipientes selados e em locais frescos, secos e bem ventilados.
Isso serve para impedir que não entre em contato com a água, pois pode reagir violentamente com ele, gerando muito calor, a ponto de queimar materiais próximos que são combustíveis.
O óxido de fósforo (v) poeira está irritando o olho e o trato respiratório e corrosivo para a pele. Pode produzir queimaduras nos olhos. Por ingestão causar queimaduras internas fatais.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Anidrido fosfórico. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Nayler, p. (2001). Bitumens: modificado. Modificação química. Na Enciclopédia de Materiais: Ciência e Tecnologia. Recuperado de cientedirect.com.
- Malishev, b.C. (1936). Pentóxido de fósforo como agente de refino para gasolina. Química Industrial e Engenharia 1936, 28, 2, 190-193. Recuperado de bares.ACS.org.
- Epps, Jr. E.PARA. (1950). Determinação fotométrica do pentóxido de fósforo disponível em fertlizers. Química analítica 1950, 22, 8, 1062-1063. Recuperado de bares.ACS.org.
- Banerjee, a. et al. (1983). Uso de pentóxido de fósforo: esterificação de ácidos orgânicos. J. Org. Chem. 1983, 48, 3108-3109. Recuperado de bares.ACS.org.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Quarta edição. John Wiley & Sons.
- Ogliari, f.PARA. et al. (2008). Síntese de monômeros de fosfato e ligação à dentina: métodos de esterificação e uso de pentóxido de fósforo. Journal of Dentistry, volume 36, edição 3, março de 2008, páginas 171-177. Recuperado de cientedirect.com.
- « Acetato de alumínio (AL (CH3CO) 3) Estrutura, propriedades, usos
- Notação desenvolvida o que é, exemplos e exercícios »

