Acetato de alumínio (AL (CH3CO) 3) Estrutura, propriedades, usos
- 2883
- 438
- Ernesto Bruen
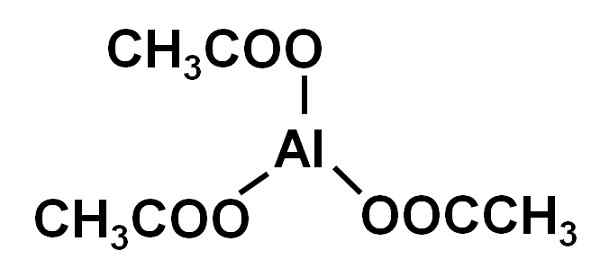
Ele acetato de alumínio É um composto orgânico formado por um íon de alumínio para o3+ e três íons acetatos CHO3COO-. Sua fórmula química é Al (Cho3COO)3. Também é conhecido como triacetato de alumínio. É um sólido levemente higroscópico e solúvel em água.
Para obter esse composto, as condições totalmente anidradas devem ser usadas, ou seja, livre de água, caso contrário, o dialeco de alumínio em (OH) (CH) tende a se formar3COO)2.
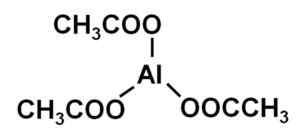 Triacetato de alumínio Al (CH3COO)3. Autor: Marilú Stea.
Triacetato de alumínio Al (CH3COO)3. Autor: Marilú Stea. As soluções de acetato de alumínio têm propriedades antibacterianas e antifúngicas; portanto, desde o século XIX, elas foram usadas para tratar infecções, especialmente dos ouvidos.
O mais conhecido é a solução de Burow, projetada por um médico alemão. No entanto, seu uso às vezes foi causado a danos ao ouvido médio.
Esta solução também foi usada para tratar problemas de pele, como coceira e erupções. É até usado como queimadura solar calmante.
O acetato de alumínio e seus derivados são usados para obter estruturas muito pequenas ou partículas de alumina para o2QUALQUER3. Essas estruturas ou nanopartículas podem estar na forma de folhas, flores ou nanotubos.
[TOC]
Estrutura
O triacate de alumínio é formado por um cátion de alumínio para o3+ e três ânions de acetato CHO3COO-. É o sal de alumínio do ácido acético CH3COOH.
O alumínio está ligado a ânions acetato através do oxigênio destes. Em outras palavras, está ligado a três oxigênio. Esses sindicatos são iônicos.
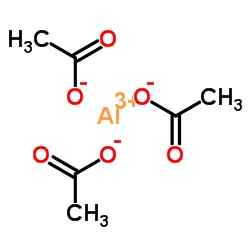 Estrutura iônica do acetato de alumínio. N4tr!UMB [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Estrutura iônica do acetato de alumínio. N4tr!UMB [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Nomenclatura
- Acetato de alumínio
- Triacetato de alumínio
- Etanoato de alumínio
- Solução de Burow (tradução para o inglês Solução de Burow): É uma solução de acetato de alumínio.
Propriedades
Estado físico
Sólido branco.
Peso molecular
204,11 g/mol
Solubilidade
Solúvel em água.
Propriedades quimicas
Em solução aquosa, o triacate de alumínio é dissolvido e tende a formar o diacetato (OH) (CH)3COO) e às vezes monoacetato em (OH)2(CH3COO). Tudo depende do pH e da quantidade de ácido acético CH3COOH presente na solução.
Pode servir a você: tensão superficial: causas, exemplos, aplicações e experimentosAL (cap3COO)3 + H2Ou ⇔ al (oh) (Cho3COO)2 + CH3COOH
AL (cap3COO)3 + 2 h2Ou ⇔ al (oh)2(CH3COO) + 2 CH3COOH
Outras propriedades
O acetato de alumínio é ligeiramente higroscópico, ou seja, tende a absorver a água do ar.
Obtenção
O acetato de alumínio é preferencialmente obtido em condições estritamente anidro, isto é, na ausência total da água. Isso também inclui ausência de ar, pois isso pode conter umidade.
Uma mistura de ácido acético glacial é aquecido3COOH e anidrido acético (CH3CO)2Ou em tais condições que permitem eliminar toda a água atual. A esta mistura quente é adicionada cloreto de alumínio ALCL3 Ashidro sólido (sem água).
Um sólido branco de Al (CH3COO)3.
Alcl3 + 3 cap3COOH → AL (CH3COO)3 + 3 hcl
A ausência total de água é importante para evitar a formação de sais de monoacetato de alumínio em (OH)2(CH3COO) e diacetato de alumínio em (OH) (CHO3COO)2.
Também pode ser obtido por reação de hidróxido de alumínio a (OH)3 e ácido acético CH3COOH.
Usos na medicina
Infecções de ouvido
O acetato de alumínio tem sido usado desde o século XIX para tratar a otite, que é uma inflamação do ouvido externo ou médio geralmente acompanhado por infecção. Seu uso é devido ao seu efeito antibacteriano e antifúngico.
Foi usado na forma de uma solução de aceitato de alumínio de 13%, originalmente criada pelo médico alemão Karl August von Burow, por isso é chamado de solução de Burow.
Verificou -se que inibe o crescimento de microorganismos que são comumente encontrados em otite média ou externa, como Pseudomonas aeruginosa, ele Staphylococcus aureus e ele Proteus mirabilis.
 Infecções por ouvido foram tratadas por muitos anos com acetato de alumínio. Autor: Ulrike Mai. Fonte: Pixabay.
Infecções por ouvido foram tratadas por muitos anos com acetato de alumínio. Autor: Ulrike Mai. Fonte: Pixabay. No entanto, há quem relate que essas soluções podem ser prejudiciais ao ouvido. Alguns estudos em animais investigam seus efeitos tóxicos para o ouvido, mas relataram resultados contraditórios.
Pode servir você: hidróxido de zinco (Zn (OH) 2)Certos pesquisadores recomendam não usar acetato de alumínio quando a membrana do tímpano é perfurada, pois foi observado que exerce um efeito inflamatório no ouvido médio.
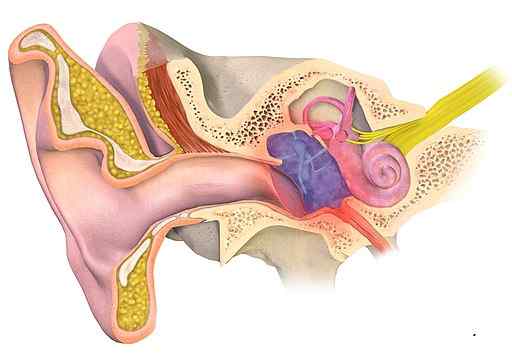 Não é conveniente tratar a otite média (zona azulada na figura) com acetato de alumínio. Bruceblaus [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Não é conveniente tratar a otite média (zona azulada na figura) com acetato de alumínio. Bruceblaus [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Doenças de pele
A solução de Burow é usada como anti -séptica, adstringente e como uma solução tópica para tratar erupções graves, dermatite, inflamação, coceira, queima e queimaduras solares. Exerce um efeito calmante e reduzido das irritações.
 Às vezes, queimaduras solares podem ser tratadas com uma solução de acetato de alumínio. Autor: Tumisu. Fonte: Pixabay.
Às vezes, queimaduras solares podem ser tratadas com uma solução de acetato de alumínio. Autor: Tumisu. Fonte: Pixabay. Outros usos
Triaceado de alumínio e seus derivados são usados para muitos experimentos químicos qualitativos e quantitativos.
Um derivado do triacetato de alumínio, diacetato em (OH) (CH3COO)2 Também chamado de acetato de hidróxido de alumínio, ele é usado como precursor para obter nanoestruturas gama-alumina (γ-al2QUALQUER3).
Nesse caso, precursor significa que, do diacetato de alumínio (obtido de uma maneira particular), as nanoestruturas γ-al são preparadas2QUALQUER3, E isso é conseguido aquecendo -o em temperaturas muito altas.
Nanoestruturas são partículas muito pequenas que só podem ser observadas através de microscópios especiais, como microscópios eletrônicos. Com acetato de alumínio como precursor, as nanoestruturas de γ foram obtidas2QUALQUER3 semelhante a folhas, flores, fibras e até nanotubos.
 Os nanofribos de alumina podem ser obtidos usando um derivado de acetato de alumínio. Aleksei TR [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Os nanofribos de alumina podem ser obtidos usando um derivado de acetato de alumínio. Aleksei TR [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Uso descontinuado
No início do século XX, o acetato de alumínio foi usado como conservante de alimentos, como salsichas enlatadas.
Uma solução de acetato de alumínio foi preparada misturando sulfato de alumínio ao2(SW4)3, Carbonato de cálcio de caco3, Ácido acético cap3COOH e Agua H2Ou, e adicionado à comida.
Quando esta solução entra em contato com a carne, o alumínio é fixado nos constituintes dela na forma de um composto insolúvel em água fervente, mas que em sucos gástricos se dissolve em aproximadamente 80%.
Pode servir a você: ácido bromo (hbro2): propriedades físicas e químicas e usosJá em 1904, sabia -se que a digestão de sais de alumínio retardou, tanto no estômago quanto no intestino. Portanto, é uma prática não conquistadora adicionar soluções de acetato de alumínio para alimentos enlatados.
 No passado, o acetato de alumínio era usado como conservante de salsicha enlatada. Atualmente é sabido que é prejudicial e não é mais usado para isso. Autor: Changlc. Fonte: Wikimedia Commons.
No passado, o acetato de alumínio era usado como conservante de salsicha enlatada. Atualmente é sabido que é prejudicial e não é mais usado para isso. Autor: Changlc. Fonte: Wikimedia Commons. Efeitos prejudiciais
Como existem estudos que relatam que o acetato de alumínio pode ser tóxico, foram realizados testes nos quais o acetato de alumínio foi injetado em ratos de laboratório.
Os resultados indicam que esse composto produz danos à espinha dorsal desses animais, bem como danos aos cromossomos e espermatozóides dos animais. Em outras palavras, é genotóxico.
Isso alerta sobre possíveis riscos à saúde que podem causar superexposição ao acetato de alumínio e os cuidados que devem ser tomados durante o uso.
Referências
- Mac-Kay Chace, e. (1904). O uso de acetato básico de alumínio como conservante em salsicha. Journla da American Chemical Society 1904, 26, 6: 662-665. Recuperado de bares.ACS.org.
- Hood, g.C. e ihde, um.J. (1950). Acetatos e propionatos de alumínio - a preparação e composição. Jornal da American Chemical Society 1950, 72, 5: 2094-2095. Recuperado de bares.ACS.org.
- PITARO, J. et al. (2013). Ototoxicidade de acetato de alumínio/solução ótica de cloreto de benzenetonium no modelo animal de chinchila. Laringoscópio, 2013; 123 (10): 2521-5. NCBI se recuperou.Nlm.NIH.Gov.
- Thorp, m.PARA. et al. (2000). Solução de Burow no tratamento da otite média de supuritivos crônicos ativos: determinar uma diluição eficaz. The Journal of Laringology & Otology, junho de 2000, vol. 114, pp.432-436. NCBI se recuperou.Nlm.NIH.Gov.
- D'OUZA, Sr.P. et al. (2014). Avaliação da genotoxi do estudo do estudo na medula óssea, células germinativas masculinas e células hepáticas fetais de camundongos albinos suíços. Mutation Research 766 (2014) 16-22. NCBI se recuperou.Nlm.NIH.Gov.
- Basal e. et al. (2015). Os efeitos das soluções tópicas de Burow e Castellani na mucosa da orelha média de ratos. J. Int Adv Otol 2015; 11 (3): 253-6. Recuperado da avançadatologia.org.
- OU.S. Biblioteca Nacional de Medicina. (2019). Acetato de silêncio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Buttaravoli, p. E Leffler, S.M. (2012). Queimadura de sol. O que fazer. Em emergência menor (terceira edição). Recuperado de cientedirect.com.
- Thompson, e. e Kalus, para. (2017). Reações de pele acte e infecções bacterianas. Tratamento. No Manual de Medicina Tropical e Tropical (Quinta Edição). Recuperado de cientedirect.com.
- Kim, t. et al. (2010). Síntese controlável de morfologia de alumínio gama. Cristal Growth & Design, vol.10, não. 7, 2010, pp.2928-2933. Recuperado de bares.ACS.org.
- Rajala, J.C. et al. (2015). Fibras de cerâmica de óxido de alumínio oco-casca de casca-casca-casca. Fibras 2015, 3, 450-462. MDPI se recuperou.com.
- « Componentes do espaço geográfico listados e como eles se relacionam
- Estrutura de óxido de fósforo (v), propriedades, obtenção, uso, riscos »

