Estrutura de óxido de estrôncio (SRO), propriedades, aplicações

- 3562
- 744
- Ernesto Bruen
Explicamos o que óxido de estrôncio, sua estrutura química, propriedades físicas e químicas, aplicações e riscos é
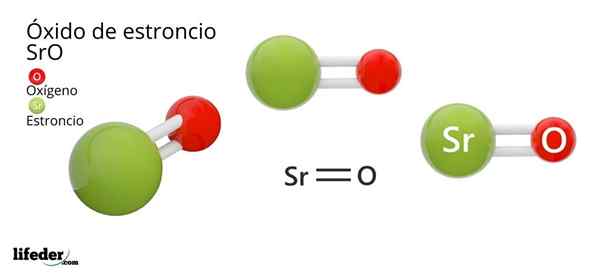
Ele Óxido de estrôncio, cuja fórmula química é SRO (não deve ser confundida com peróxido de estrôncio, que é SRO2), é o produto da reação oxidativa entre esse metal e o oxigênio presente no ar à temperatura ambiente: 2SR (s) + O2 (g) → 2sro (s).
Um pedaço de estrôncio queima em contato com o ar como resultado de sua alta reatividade e, como possui uma configuração eletrônica do tipo NS2, seus dois elétrons de valência produzem facilmente, especialmente a molécula de oxigênio diatômica.
Se a área da superfície do metal for aumentada pulverizando -a até que tenha um pó finamente dividido, a reação ocorre imediatamente e até queima com uma chama intensa avermelhada. Strontium, metal que participa dessa reação, é um metal do grupo 2 da tabela periódica.
Este grupo consiste nos elementos conhecidos como alcalinos. O primeiro dos elementos liderados pelo grupo é o berílio, seguido de magnésio, cálcio, estrôncio, bário e, finalmente, o rádio. Esses elementos são de natureza metal e, como uma regra mnemônica para lembrar deles, a expressão pode ser usada: “SR. Becambara ".
O "MR" ao qual a expressão se refere não é outro senão o estrôncio metal (SR), um elemento químico muito reativo que não é naturalmente encontrado em sua forma pura, mas combinada com outros elementos do ambiente ou seus arredores para dar origem a Seus sais, nitretos e óxidos.
Por esse motivo, minerais e óxido de estrôncio são os compostos em que o estrôncio é encontrado na natureza.
[TOC]
Propriedades físicas e químicas do óxido de estrôncio
 Aparência física de óxido de estrôncio
Aparência física de óxido de estrôncio O óxido de estrôncio é um composto branco sólido, poroso e do banheiro e, dependendo de seu tratamento físico, pode ser encontrado no mercado como poeira fina, como cristais ou como nanopartículas.
Pode atendê -lo: óxidosSeu peso molecular é 103.619 g/mol e tem um alto índice de refração. Possui pontos de fusão (2531 ºC) e ebulição (3200 ° C), o que se traduz em fortes interações de ligação entre estrôncio e oxigênio. Este alto ponto de fusão o torna um material termicamente estável.
Óxido básico
É um óxido altamente básico; Isso significa que ele reage à temperatura ambiente com água para formar hidróxido de estrôncio (SR (OH) 2):
SRO (S) + H2O (L) → SR (OH) 2
Solubilidade
Ele também reage ou mantém a umidade, característica essencial dos compostos higroscópicos. Portanto, o óxido de estrôncio tem alta reatividade com água.
Em outros solventes - por exemplo, álcoois como o etanol da farmácia ou metanol - são levemente solúveis; Enquanto em solventes como acetona, éter ou diclorometano, é insolúvel.
Por que é assim? Como os óxidos metálicos -e ainda mais os formados a partir de metais alcalinotherrosos -são compostos polares e, portanto, interagem em melhor grau com solventes polares.
Não apenas pode reagir com água, mas também com dióxido de carbono, produzindo carbonato de estrôncio:
SRO (s) + CO2 (g) → SRCO3 (s)
Ele reage com os ácidos - como por exemplo, ácido fosfórico diluído - para produzir sal e sal do sal fosfato:
3SRO (s) + 2 H3PO4 (DIL) → SR3 (PO4) 2 (S) + 3H2O (G)
Essas reações são exotérmicas, e é por isso que a água produzida é evaporada por altas temperaturas.
Estrutura química
A estrutura química de um composto explica como é seus átomos no espaço. No caso de óxido de estrôncio, apresenta uma estrutura cristalina do tipo Gem Salt, o mesmo sal de mesa ou cloreto de sódio (NaCl).
Pode atendê -lo: bicarbonato de cálcioAo contrário de NaCl, o sal monovalente -isto é, com cátions e ânions de uma magnitude de carga (+1 para Na e -1 para o Cl) -, o SRO é divalente, com 2+ cargas para o SR e de -2 para O (o2-, ânion de óxido).
Nesta estrutura, cada íon O2- (vermelho) é cercado por seis outros óxidos volumosos, hospedando em seus interstícios octaédricos resultantes os íons sr2+ (cor verde), menor. Esta embalagem ou arranjo é conhecida como célula unitária cúbica centrada em faces (CCC).
Tipo de link
A fórmula química do óxido de estrôncio é SRO, mas não explica absolutamente a estrutura química ou o tipo de link existente.
Na seção anterior, foi mencionado que apresenta uma estrutura de sal de Gema; isto é, uma estrutura cristalina muito comum para muitos sais.
Portanto, o tipo de link é predominantemente iônico, o que esclareceria por que esse óxido tem altos pontos de fusão e ebulição.
Como o link é iônico, são as interações eletrostáticas que mantêm os átomos de estrôncio e oxigênio juntos: sr2+ o2-.
Se esse vínculo fosse covalente, o composto poderá ser representado com links em sua estrutura de Lewis (omitindo os elétrons de oxigênio não compartilhados).
Formulários
As propriedades físicas de um composto são essenciais para prever quais seriam suas aplicações em potencial na indústria; Portanto, estes são um reflexo macro de suas propriedades químicas.
Substituto principal
Óxido de estrôncio, graças à sua alta estabilidade térmica, encontra muitas aplicações nas indústrias de cerâmica, vidro e óptica.
Seu uso nessas indústrias visa principalmente substituir o chumbo e ser um aditivo que confere melhores cores e viscosidades à matéria -prima dos produtos.
Pode atendê -lo: alugar halogenuros: propriedades, obtenção, exemplosQuais produtos? A lista não teria fim, porque em nenhum deles tem vidro, esmaltes, cerâmica ou cristais em uma de suas peças, o óxido de estrôncio pode ser útil.
Indústria aeroespacial
Como é um sólido muito poroso, ele pode intercalar partículas menores e, assim.
Catalisador
Essa mesma porosidade permite que você tenha usos potenciais como catalisador (acelerador de reações químicas) e como trocador de calor.
Fins eletrônicos
O óxido de estrôncio também serve como fonte de produção de Strban puro para fins eletrônicos, graças à capacidade desse metal de absorver raios X; E para a preparação industrial de seu hidróxido, SR (OH) 2, e seu peróxido, SRO2.
Riscos de saúde
É um composto corrosivo, para que possa causar queimaduras com contato físico simples em qualquer lugar do corpo. É muito sensível à umidade e deve ser armazenado em espaços secos e frios.
O produto dos sais da reação desse óxido com diferentes ácidos se comportam no corpo e como sais de cálcio, e são armazenados ou expulsos por mecanismos semelhantes.
Na época, o óxido de estrôncio por si só não representa maiores riscos à saúde.
Referências
- Elementos americanos. (1998-2018). Elementos americanos. Recuperado dos americanos.com
- Shiver & Atkins. (2008). QUÍMICA INORGÂNICA. Nas estruturas de sólidos simples (quarta ed., p. 84). Mc Graw Hill.
- Atsdr. Recuperado de ASDR: ATSDR.CDC.Gov
- Clark, j. (2009). Chemguide. Recuperado de Chemguide.co.Reino Unido
- Tiwary, r., Narayan, s., & Pandey, ou. (2007). Preparação de óxido de sontium do Celestite: uma revisão. Materiais Science, 201-211.

