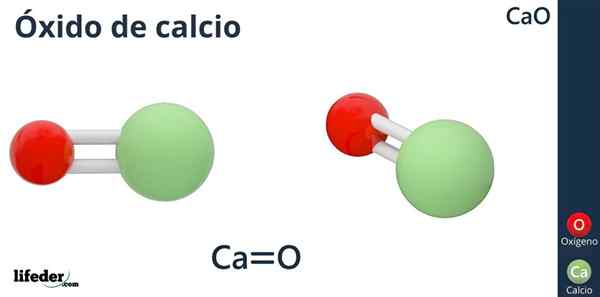
Óxido de cálcio (CAO)
- 3180
- 111
- Melvin Mueller
O que é óxido de cálcio?
Ele óxido de cálcio (CAO) é um composto inorgânico que contém cálcio e oxigênio em formas iônicas (para não confundir com peróxido de cálcio, cao2). Mundial conhecido como cal, uma palavra que designa todo composto inorgânico que contém carbonatos, óxidos e hidróxidos de cálcio, além de outros metais como silício, alumínio e ferro.
A esse óxido (ou cal) também se refere coloquialmente como viva ou limão, dependendo se está ou não hidratado. Lime ao vivo é óxido de cálcio, enquanto o limão é seu hidróxido. Por sua vez, calcário (cal ou limão endurecido) é na verdade uma rocha sedimentar composta principalmente de carbonato de cálcio (caco3).
É uma das maiores fontes naturais de cálcio e constitui a matéria -prima para a produção de óxido de cálcio. Como esse óxido é produzido? Os carbonatos são suscetíveis à decomposição térmica; Aquecimento de carbonatos de cálcio a temperaturas maiores que 825 ºC, levam à formação de cal e dióxido de carbono.
A declaração anterior pode ser descrita da seguinte forma: caco3(s) → Cao (s) + CO2(g). Como a crosta terrestre é rica em calcário e calcita, e nos oceanos e nas praias as conchas do mar (matérias -primas para a produção de óxido de cálcio) são abundantes, o óxido de cálcio um reagente relativamente barato.
Fórmula
A fórmula química do óxido de cálcio é CAO, na qual o cálcio é como o íon ácido (aceitador de elétrons) CA2+, e oxigênio como o íon básico (doador de elétrons) ou2--.
Por que o cálcio tem uma carga +2? Porque o cálcio pertence ao grupo 2 da tabela periódica (SR. Scholambara), e só tem dois elétrons de valência disponíveis para formação de links, que produzem o átomo de oxigênio.
Pode servir você: óxido de potássio (K2O)Estrutura de óxido de cálcio
 Estrutura cristalina de óxido de cálcio
Estrutura cristalina de óxido de cálcio A estrutura cristalina (tipo de sal gem) para óxido de cálcio é representado na imagem superior. Esferas vermelhas volumosas correspondem a íons CA2+ e esferas brancas para íons ou2-.
Neste arranjo cristalino cúbico todos os íons ca2+ é cercado por seis íons ou2-, Ocorrido nos buracos octaédricos deixados por grandes íons entre eles.
Essa estrutura expressa ao máximo o caráter iônico desse óxido, embora a notável diferença de rádios (a esfera vermelha seja maior que branca) dê uma energia reticular cristalina mais fraca se comparada ao MGO.
Propriedades de óxido de cálcio
 Aparência de óxido de cálcio
Aparência de óxido de cálcio Fisicamente, é um sólido branco cristalino, vaso sanitário e com fortes interações eletrostáticas, responsáveis por seus pontos altos de fusão (2572 ºC) e ebulição (2850 ºC). Além disso, tem um peso molecular de 55.958 g/mol e a propriedade interessante de ser termoluminescente.
Isso significa que um pedaço de óxido de cálcio exposto a uma chama pode brilhar com intensa luz branca, conhecida em inglês com o nome RIBALTA, ou em espanhol, luz de cálcio. Os íons ca2+, Em contato com o fogo, eles originam uma chama avermelhada, como pode ser visto na imagem a seguir.
 Luz de cálcio ou holofotes
Luz de cálcio ou holofotes Solubilidade
O CAO é um óxido básico que tem uma forte afinidade pela água, a um grau que absorve a umidade (é um sólido higroscópico), reagindo imediatamente para produzir desligado ou hidróxido de cálcio:
CAO (s) + H2Ou (L) => CA (OH)2(S)
Essa reação é exotérmica (desiste do calor) devido à formação de um sólido com interações mais fortes e uma rede cristalina mais estável. No entanto, a reação é reversível se o CA (OH) for aquecido2, desidratando e iluminando o limão; Então, o limão "Reborn".
Pode servir a você: safranina: características, uso, técnicas, toxicidadeA solução resultante é muito básica e, se saturada com óxido de cálcio, atinge um pH de 12,8.
Da mesma forma, é solúvel em glicerol e em soluções ácidas e açucaradas. Como é um óxido básico, naturalmente possui interações eficazes com óxidos ácidos (SIO2, Para o2QUALQUER3 e fé2QUALQUER3, por exemplo) ser solúvel nas fases líquidas deles. Por outro lado, é insolúvel em álcoois e solventes orgânicos.
Usa/aplicações
O CAO possui um vasto usos industriais incontáveis, bem como na síntese de acetileno (CHidor), na extração de fosfatos de águas residuais e na reação com o dióxido de enxofre de refrigerantes.
Outros usos do óxido de cálcio são descritos abaixo:
Como argamassa
Se o óxido de cálcio for misturado com areia (SIO2) e água, bolos com areia e reagem lentamente com a água para formar limão opaco. Por sua vez, co2 Do ar se dissolve na água e reage com o sal para formar carbonato de cálcio:
CA (OH)2(s) + CO2(g) => caco3(s) + h2Ou (l)
O caco3 É um composto mais resistente e duro que o CAO, fazendo com que a argamassa (a mistura anterior) endureça e conserte os tijolos, blocos ou cerâmica entre eles ou com a superfície desejada.
Na produção de vidro
A matéria -prima essencial para a produção de vidro são os óxidos de silício, que são misturados com cal, carbonato de sódio (NA2Co3) e outros aditivos, e depois submetidos ao aquecimento, resultando em um sólido vítreo. Este sólido é posteriormente aquecido e soprado em quaisquer figuras.
Na mineração
O limão opaco ocupa um volume maior que o limão vivo devido às interações por pontes de hidrogênio (O-H-O). Esta propriedade é explorada para quebrar as rochas de seus considerações.
Pode atendê -lo: hidrogenação catalíticaIsso é conseguido enchendo -os com uma mistura compacta de cal e água, que é selada para focar seu calor e poder expansivo dentro da rocha.
Como agente de removedor de silicatos
O CAO se funde com os silicatos para formar um líquido coalescente, que é então extraído da matéria -prima de um determinado produto.
Por exemplo, os minerais de ferro são a matéria -prima para a produção de ferro e aço metálico. Esses minerais contêm silicatos, que são impurezas indesejáveis para o processo e são eliminadas pelo método recentemente descrito.
Nanopartículas de óxido de cálcio
O óxido de cálcio pode ser sintetizado como nanopartículas, variando as concentrações de nitrato de cálcio (CA (NO3)2) e hidróxido de sódio (NaOH) em solução.
Essas partículas são esféricas, básicas (e também a escala sólida a macro) e têm muita área de superfície. Consequentemente, essas propriedades beneficiam processos catalíticos. Qual? Investigações estão atualmente respondendo a essa pergunta.
Essas nanopartículas foram usadas para sintetizar compostos orgânicos substituídos - como derivado da piridina - na formulação de novos medicamentos para realizar transformações químicas como fotossíntese artificial, para purificação da água de metais pesados e nocivos e como agentes fotocatalíticos.
As nanopartículas podem ser sintetizadas em apoio biológico, como mamão e folhas de chá verde, para dar -lhes o uso como um agente antibacteriano.
Referências
- Scifun.org. (2018). Cal: óxido de cálcio. Recuperado de: scifun.org.
- Wikipedia. (2018). Óxido de cálcio. Recuperado de: em.Wikipedia.org
- PubChem. (2018). Óxido de cálcio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Shiver & Atkins. (2008). Química Inorgânica. Em Os elementos do grupo 2. (quarta edição., p. 280). Mc Graw Hill.