Estrutura de óxido de alumínio, propriedades, usos, nomenclatura
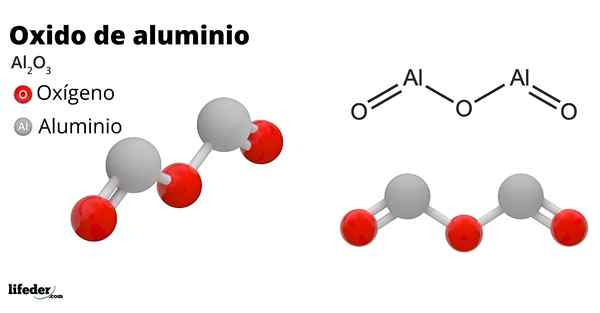
- 4434
- 1128
- Terrence King IV
Ele óxido de aluminio, Também chamado de alumina, óxido de alumínio, corindon ou trióxido de alumínio, é um composto inorgânico cuja fórmula química é para o2QUALQUER3. É um óxido de anfótero, embora possa se tornar, devido ao tratamento, um composto quase inerte.
Tem grande dureza, resistência à corrosão e alta resistência elétrica. Essas propriedades, entre outras, permitiram que o óxido de alumínio tivesse inúmeras aplicações, como: isolamento elétrico, material abrasivo, implantes de ossos e dentes, etc.
A bauxita é a principal fonte para obter óxido de alumínio. O Corindon, por outro lado, é um mineral de óxido de alumínio que está no estado livre na forma de α-al2QUALQUER3. O Corindon tem uma dureza de 9.0, e devido a algumas impurezas, produz pedras preciosas, como safira e rubi.
A eletrólise de óxido de alumínio serviu de base para o isolamento de alumínio por Humphry Davy em 1808. Esse mesmo método, com algumas adaptações, é atualmente usado na produção metálica de alumínio.
[TOC]
Estrutura
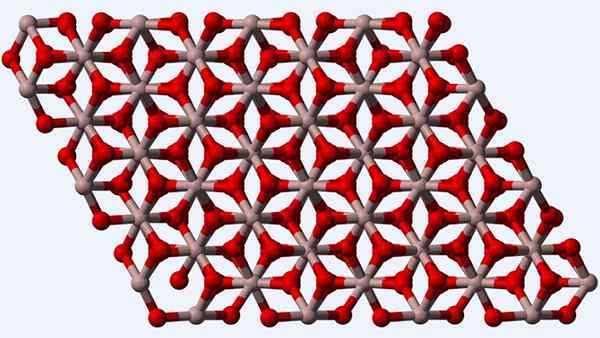 Estrutura cristalina da fase α-al2O3 ou Corindon
Estrutura cristalina da fase α-al2O3 ou Corindon O Corindon ou a fase α-al2QUALQUER3, Por ser o polimorfo termodinamicamente mais estável para óxido de alumínio, sua estrutura (imagem superior) é considerada a principal no momento de sua caracterização. Esta estrutura é trigonal, com os íons para o3+ cercado por seis ou2-, e, portanto, estabelecendo octadros al6 com interações al-o u al-o.
Além do Corindón, Al2QUALQUER3 Também existe como outros polimorfos metaestáveis, incluindo: γ-al2QUALQUER3 e η-al2QUALQUER3 (cúbico), θ-AT2QUALQUER3 (monoclínico), χ-al2QUALQUER3 (hexagonal), κ-al2QUALQUER3 (Ortorrombic) e Δ-al2QUALQUER3 (Tetragonal ou ortorrombic).
Como o Al2QUALQUER3, Os octaedros estão "quebrando" em tetraedros al4 o Pentaedros alo5. Depois de derretido e esfriar novamente, você pode obter um óxido de alumínio vítreo, ou seja, amorfo, com misturas de poliedros alm5 já o6.
Pode atendê -lo: Einstenio (s): estrutura, propriedades, obtenção, usosPropriedades de óxido de alumínio
 Peças de alumínio de metal fundido com revestimento de óxido de alumínio
Peças de alumínio de metal fundido com revestimento de óxido de alumínio Aparência física
Pó cristalino sólido ou branco
Massa molar
101.96 g/mol
Cheiro
Lavatório
Densidade
3.798 g/cm3
Ponto de fusão
2072 ºC
Ponto de ebulição
2977 ºC
Solubilidade
Insolúvel em todos os solventes, incluindo água.
Condutividade térmica
30 w · m-1· K-1. Apesar de seu uso de cerâmica, ele tem uma condutividade térmica relativamente alta.
Índice de refração
1.768-1.760
Dureza
É um composto que apresenta uma dureza muito alta, com um valor de 9.0 Na escala de dureza Mohs na forma de óxido de α-alumínio (Corindón).
Resistividade elétrica
A 300 ° C: 1.2 x 1013 Ohms · cm. O óxido de alumínio ou alumina é, portanto, um isolador elétrico.
Reatividade
Al2QUALQUER3 Apesar de reagir fracamente com álcalis e, em maior medida, com os ácidos, é considerado um anfóter químico. No entanto, quando é aquecido a mais de 800 ° C, adquire um estado quase inerte à ação dos ácidos.
Este óxido é responsável por proteger o alumínio em frente a agentes corrosivos ambientais, pois cobre firmemente a superfície do metal sem desmoronar ou rachadura.
Nomenclatura
A nomenclatura de Al2QUALQUER3 é simples. Sistematicamente conhecido como trióxido de diumumum. Como esse óxido de alumínio existe, em sua nomenclatura de ações, o Valencia de metal (III) não é especificado. Além disso, seu nome é tradicionalmente resumido para óxido de alumínio, tendo apenas uma valência.
Usa/aplicações
Vidro
O óxido de alumínio intervém na elaboração de vidro de alumínio-silicato. Este vidro refratário, resistente ao choque térmico, pode ser usado em temperaturas mais altas que o vidro de silicato de boro; Embora tenha menor resistência química.
A adição de uma pequena quantidade de magnésia transforma o vidro opaco de alumina em translúcido, podendo ser usado como um recipiente de gás nas lâmpadas de vapor de sódio de alta pressão. Também é usado na preparação de suspensões de revestimento de certos tipos de lâmpadas fluorescentes.
Pode atendê -lo: Rodio: História, Propriedades, Estrutura, Usos, RiscoCatalisador
A alumina ativada tem uma característica granular e porosa que pode ter atividade catalítica ou servir como suporte para a atividade de outros catalisadores. Entre outros processos, a alumina intervém na catálise da polimerização do óxido de etileno.
Atividade microbicida
As partículas de óxido de nano-alumínio aderem à superfície das bactérias, causando sua morte. Da mesma forma, um efeito semelhante no fungo do gênero Candida foi evidenciado.
Isolador elétrico
O óxido de alumínio tem uma alta resistividade elétrica, o que lhe dá a capacidade de atuar como um isolador elétrico. Portanto, é usado em pacotes de circuito integrados. Também é usado em dispositivos supercondutores e como condensador dielétrico ou capacitores. Além disso, é usado como isolador em velas elétricas.
Abrasivo
 O Corindon, o cristalino e mais resistente do óxido de alumínio, serve para construir ferramentas abrasivas. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0, CC BY-SA 3.0, via Wikimedia Commons
O Corindon, o cristalino e mais resistente do óxido de alumínio, serve para construir ferramentas abrasivas. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0, CC BY-SA 3.0, via Wikimedia Commons A alta dureza do mineral de Corindon permite que ele seja usado como abrasivo, de menor custo que os diamantes, na indústria e na perfuração de petróleo.
O Corindon adquire a forma preciosa da pedra, como o rubi vermelho, por causa da contaminação do cromo; ou como safira azul, devido à poluição de ferro e titânio. Muitos tipos de lixa usados em metal e madeira têm cristais de óxido de alumínio.
A tenacidade ou capacidade de evitar a ruptura do óxido de alumínio aumenta com a adição de zircônia ou carboneto de silício, o que permite que ele seja usado em ferramentas industriais de corte. Além disso, o óxido de alumínio é usado em cremes dentários para polimento de dentes.
Pode atendê -lo: cromato de zinco: estrutura, propriedades, obtenção, usosTambém algumas apresentações de óxido de alumínio são usadas como abrasivos por dermatologistas no tratamento de certas condições de pele.
Desumidificador de gás
O óxido de alumínio é um composto com ávido pela água, para que possa ser usado para extraí -lo de correntes gasosas.
Retardador de chama
As nanopartículas de hidróxido de óxido de alumínio (Bohemita) atuam como um dissipador de calor, liberando água e atrasando a aparência das chamas.
Implantes de tecido duro
O óxido de alumínio é um composto de grande dureza, resistente a inertes quimicamente e de corrosão, além de ter uma cor branca. Para essas qualidades, é usado como substituto para tecidos duros, como ossos e dentes. Da mesma forma, o material construído com óxido de alumínio foi usado na substituição da articulação.
Obtenção
 Amostra de bauxita. Fonte: máx.Kit, CC BY-SA 4.0, via Wikimedia Commons
Amostra de bauxita. Fonte: máx.Kit, CC BY-SA 4.0, via Wikimedia Commons O bauxita é o principal mineral para obter óxido de alumínio, sendo formado pela mistura de três minerais: Gibbsite, Laboehmita e Diáspora.
O óxido de alumínio é extraído de seus minerais pelo procedimento da Bayer. Isso consiste na reação de bauxita quente com hidróxido de sódio, uma reação produzida por aluminato de sódio [Naal (OH)4].
Quando a solução anterior é resfriada, a precipitação de hidróxido de alumínio é produzida em forma sólida. Então esse hidróxido é aquecido até 1100 ° C, produzindo óxido de alumínio.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Alumínio de óxido. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Alumínio de óxido. Resumo do PubChem Comunund para CID 9989226. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Kushagri s. et al. (2019). Potencialidade antiviral e antimicrobiana de drogas nano: óxido de alumínio de nanopartículas. Recuperado de: ScientEdirect.com
- Os editores da Enyclopaedia Britannica. (2020). Alumina. Recuperado de: Britannica.com
- Lohninger Hans. (15 de agosto de 2020). Alumínio de óxido. Química Librettexts. Recuperado de: química.Librettexts.org
- « Mecanismo de substituição eletrofílica aromática e exemplos
- 30 exemplos de ética e moral na vida cotidiana »

