Mecanismo de substituição eletrofílica aromática e exemplos

- 1235
- 96
- Dennis Heidenreich
O Substituição eletrofílica aromática (Sear) É uma reação orgânica na qual uma espécie pobre em elétrons, ou seja, uma eletrofia, substitui um dos hidrogênios de um anel aromático. Essa reação se opõe às adições sofridas pelos alcenos, demonstrando o efeito da aromaticidade nas reatividades do benzeno e seus derivados.
O eletrofilo, muitas vezes, é gerado durante o mesmo mecanismo molecular, produto da mistura dos reagentes e um catalisador, que consiste em um ácido de Lewis, por exemplo, todos3 ou FECL3. Esses catalisadores aumentam a avidez do eletrofilo pelos elétrons do anel aromático, acelerando assim a reação.
 Na substituição eletrofílica aromática, é o anel de benzeno que ataca o eletrofilo. Fonte: Gabriel Bolívar via Molview.
Na substituição eletrofílica aromática, é o anel de benzeno que ataca o eletrofilo. Fonte: Gabriel Bolívar via Molview. Na imagem superior, temos uma representação simples do ataque eletrofílico do benzeno em relação ao eletrofilo e+. Observe que o ataque vem dos elétrons de uma de suas ligações duplas; isto é, são os elétrons do sistema π conjugado que inicia a queima.
Essa reação torna possível para o benzeno e outros compostos aromáticos adquirir substituintes como os grupos de OH, não2, SW3H, cl, br, r, cor, coch3, entre outros. Por exemplo, o fenol é sintetizado via Sear a partir de benzeno e outros derivados.
[TOC]
Mecanismo de substituição eletrofílica aromática
Etapa 1: ataque eletrofílico
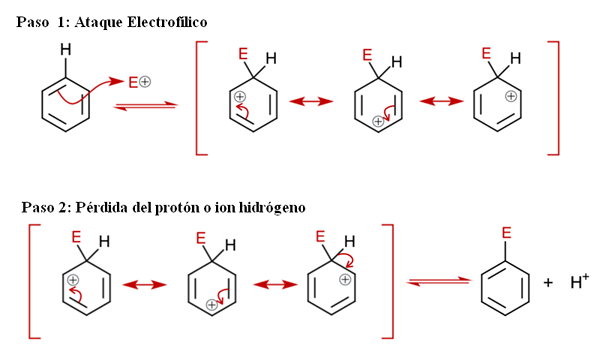 Mecanismo geral para sear. Fonte: Soonlorpai via Wikipedia.
Mecanismo geral para sear. Fonte: Soonlorpai via Wikipedia. Na imagem superior, o mecanismo de substituição eletrofílica aromática é representada em mais detalhes. Qualquer uma das três ligações duplas de benzeno ataca o eletrofilo e+, Para formar uma espécie intermediária conhecida como arenio de íons (ciclohexadien delocalizado), trancados em suportes vermelhos.
Pode atendê -lo: precipitação químicaObserve que a carga positiva de E+ Agora vá para o interior do anel. Mas não apenas isso: ele se muda entre três átomos de carbono em posições de Orto (adjacente) e para (oposto) para o carbono ligado a E (C-E). Este intermediário existe precisamente graças à estabilidade conferida por suas estruturas de ressonância.
Etapa 2: Perda do íon próton ou hidrogênio
No entanto, o arenio deve em breve neutralizar sua carga positiva, perdendo um próton ou íon de hidrogênio. É aqui que a substituição culmina. O eletrofilo e+ portanto, substitui um dos hidrogênios de benzeno, deixando isso como íon h+ fora do anel, para que cargas positivas sejam preservadas.
Se for observado com cuidado, todas as etapas estão em equilíbrio, portanto a substituição é reversível. Isto é, se as concentrações de h forem aumentadas+, Então um hidrogênio substituirá E e obteremos os reagentes novamente.
Exemplos de substituição eletrofílica aromática
Benzeno
O benzeno sear é o mais simples de todos, já representado acima. Qualquer um dos hidrogênios pode ser substituído por e+, Porque todos são quimicamente equivalentes.
Não há diferenças um do outro. Portanto, a probabilidade de que a substituição ocorra em um dos seis átomos de carbono seja a mesma. No entanto, tudo muda quando há outros substituintes presentes no anel benzênico, como veremos abaixo.
Fenol
Ortho, para e ataques de gols
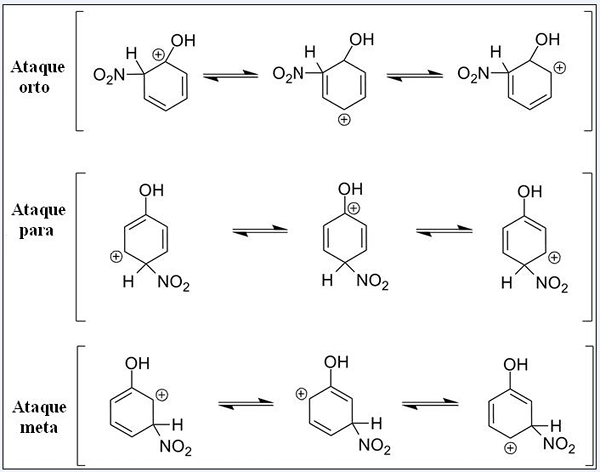 Estruturas de ressonância para fenol em sua reação de substituição eletrofílica aromática. Fonte: Pete Davis, domínio público, via Wikimedia Commons
Estruturas de ressonância para fenol em sua reação de substituição eletrofílica aromática. Fonte: Pete Davis, domínio público, via Wikimedia Commons Considere agora o sear para o Fenol. Desta vez, a eletrofia é o cátion nitroniano, não2+, que ao vincular ao anel benzeno é transformado no grupo nitro, -no2.
Pode atendê -lo: nitratos: propriedades, estrutura, nomenclatura, treinamentoAgora que um grupo de OH está presente, os outros hidrogênios deixam de ser quimicamente equivalentes; Alguns são mais suscetíveis a serem substituídos do que outros. Além disso, OH exerce uma influência direta neste momento.
Up, temos três substituições em diferentes posições relacionadas a OH: Ortho Attacks, para e gol. Observe que nos três temos o cátion arenoso e suas estruturas de ressonância. Nos ataques de orto e, a carga positiva dentro do anel benzeno está localizada no carbono ligado ao OH; Enquanto estiver no ataque alvo, isso não acontece.
Oh como um grupo orto e para diretor
OH apresenta a capacidade de produzir elétrons ao anel por ressonância e indução. Em ambos, pode ajudar. Pelo contrário, quando o ataque alvo ocorre, oh não pode estabilizar a carga positiva da mesma maneira, sendo a estrutura mais instável.
Portanto, os ataques de Ortho e para mais energia favorecidos. Dizem então que oh é um grupo de diretores de orto-for, que também pode ativar o anel benzênico em direção a Sear. Isto é, o fenol reage muito mais rápido que o benzeno, o que é demonstrado medindo as velocidades de reação.
Arilamines
 Estruturas de ressonância para anilina em sua reação de substituição eletrofílica aromática. Fonte: V8rik na Wikipedia inglesa, CC BY-SA 3.0, via Wikimedia Commons
Estruturas de ressonância para anilina em sua reação de substituição eletrofílica aromática. Fonte: V8rik na Wikipedia inglesa, CC BY-SA 3.0, via Wikimedia Commons O caso dos arilaminas, como o da anilina (imagem superior), é semelhante ao do fenol. Observe que em seu mecanismo desta vez a estabilização da carga positiva no átomo de nitrogênio (H2N+=), ajudando a substituição a ser orientada para posições de orto e, como no OH.
Pode servir a você: teorias ácidas: Arrhenius, Bronsted-Lowry, LewisAgora, a anilina é mais reativa que o fenol contra a substituição eletrofílica. Porque? Porque o átomo de nitrogênio é menos eletronegativo que o de oxigênio, e é por isso que dá a seu par de elétrons livres mais facilmente ao anel aromático. Oxigênio, por ser mais eletronegativo, produz um de seus pares de elétrons com menos "avidez".
Além disso, o raio atômico do nitrogênio é mais próximo do tamanho do carbono. Isso tem um impacto no fato de que a ressonância ocorre especialmente entre átomos com rádios ou tamanhos semelhantes. Portanto, a ressonância entre carbono e nitrogênio é um pouco mais estável e eficiente do que a entre carbono e oxigênio.
Clorobenzeno
No clorobenzeno, por outro lado, o átomo de Cl diminui a substituição devido à sua eletronegatividade. E embora também seja capaz de doar elétrons devido à ressonância ao anel, seu raio atômico é consideravelmente maior que o de carbono, diminuindo, portanto, a referida contribuição eletrônica.
Em resposta, o clorobenzeno reage 50 vezes mais lento que o benzeno, pois seu anel é desativado por causa do cloro. E também, atraindo elétrons em sua direção, o cloro é um grupo -alvo, de modo que as substituições ocorrerão predominantemente nessa posição.
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Composto aromático. Recuperado de: em.Wikipedia.org
- Ed Vitz et al. (8 de setembro de 2020). Hidrocarbonetos aromáticos. Química Librettexts. Recuperado de: química.Librettexts.org
- Wyman Elizabeth. (2020). Hidrocarbonetos aromáticos: definição, exemplo e uso. Estudar. Recuperado de: estudo.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). A complexidade química da gasolina automotiva. Ciência, Engenharia e Aplicações,2(2), 51-79. Doi: doi.org/10.22206/cyap.2019.V2i2.Pp51-79
- « Características de energia térmica, obtenção, transferência
- Estrutura de óxido de alumínio, propriedades, usos, nomenclatura »

