Voltamperometria
- 1727
- 344
- Melvin Mueller
 Voltamperometria é um método eletroquímico que mede a corrente de um eletrodo
Voltamperometria é um método eletroquímico que mede a corrente de um eletrodo O que é voltamperometria?
O voltamperometria É uma técnica eletroanalítica que determina informações de uma espécie química ou analisa das correntes elétricas geradas pela variação de um potencial aplicado. Ou seja, o potencial e (v) aplicado e o tempo (t) são as variáveis independentes; Enquanto a atual (a), a variável dependente.
As espécies químicas normalmente devem ser eletroativas. Isso significa que ele deve perder (oxidar) ou ganhar (reduzir) elétrons. Para que a reação inicie, o eletrodo de trabalho deve fornecer o potencial necessário teoricamente pela equação de Nernst.
Este método é amplamente utilizado na química inorgânica, bioquímica e física, especialmente para analisar processos de oxidação, redução ou adsorção, entre outros.
Como funciona a voltamperometria?
Voltamperometria foi desenvolvido graças à invenção do Prêmio Nobel Nobel de 1922, Jaroslav Heyrovsky (1890-1967). Nele, o eletrodo de queda de mercúrio (EGM) é constantemente renovado e polarizado.
As deficiências analíticas desse método na época foram resolvidas com o uso e o design de outros microeletrodos. Eles variam muito de material, de carvão, metais nobres, diamantes e polímeros, mesmo em seu design, discos, cilindros, folhas; Além disso, na maneira como eles interagem com a solução: estacionário ou rotativo.
Todos esses detalhes são pretendidos1). Isso é proporcional à concentração do analito e metade do poder e (e (e1/2) para atingir metade desta corrente (i1/2) é característico da espécie.
Então, determinando os valores de E1/2 Na curva onde a corrente obtida com a variação de e é gráfica, chamada voltamperaograma, A presença de um analito pode ser identificada. Isto é, cada analito, dadas as condições do experimento, terá seu próprio valor de e1/2.
Pode atendê -lo: ponto de equivalênciaOnda voltamperométrica
Na Voltamperometria, trabalhamos com muitos gráficos. O primeiro é a curva e vs. t, que permite monitorar as potenciais diferenças aplicadas em função do tempo.
Mas, ao mesmo tempo, o circuito elétrico registra os valores C produzidos pelo analito ao perder ou ganhar elétrons nas proximidades do eletrodo.
Como o eletrodo é polarizado, menos analito pode ser espalhado do seio da solução para ele. Por exemplo, se o eletrodo tiver uma carga positiva, espécies x- Ele será atraído por isso e o levará por mera atração eletrostática.
Mas x- não está sozinho: existem outros íons presentes em seu ambiente. Alguns cátions m+ Eles podem impedir o caminho para o eletrodo localizando -o em "aglomerados" de cargas positivas; E também, ânions n- Eles podem ser roubados ao redor do eletrodo e impedir x- Eu chego a ele.
A soma desses fenômenos físicos faz com que a corrente seja perdida, e isso é observado no C vs. E e sua forma semelhante à de A S, chamada de forma sigmóide. Esta curva é conhecida como onda voltamperométrica.
Instrumentação
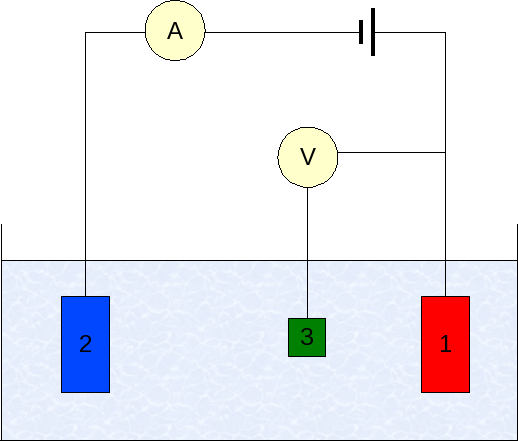 Eletrodos em voltamperometria. Fonte: Wikimedia Commons
Eletrodos em voltamperometria. Fonte: Wikimedia Commons A instrumentação da voltamperometria varia de acordo com o analito, solvente, tipo de eletrodo e aplicação. Porém, a grande maioria deles é baseada em um sistema composto por três eletrodos: um de trabalho (1), auxiliar (2) e referência (3).
O principal eletrodo de referência usado é o eletrodo Calomenanos (ECS). Isso, juntamente com o eletrodo de trabalho, permite estabelecer uma diferença de potencial ΔE, uma vez que o potencial do eletrodo de referência permanece constante durante as medições.
Pode atendê -lo: selênio: história, propriedades, estrutura, obtenção, usosPor outro lado, o eletrodo auxiliar é responsável por controlar a carga que passa para o eletrodo de trabalho, a fim de mantê -lo dentro dos valores aceitáveis. A variável independente, a diferença de potencial aplicada, é a obtida pela soma dos potenciais dos eletrodos de trabalho e da referência.
Tipos de voltamperometria
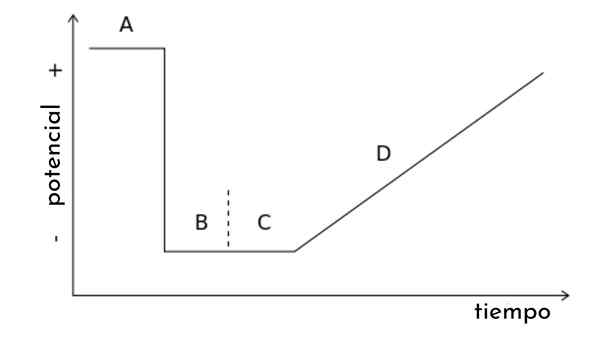
Na imagem do artigo, um gráfico é mostrado. t, também chamado de onda potencial para varredura linear voltamperometria.
Pode -se observar que, com o passar do tempo, o potencial aumenta. Por sua vez, essa varredura gera uma curva de resposta, ou voltamperaogram C vs. E, cuja forma será sigmóide. Chegará um ponto em que, independentemente de como ele aumentar, não haverá um aumento na corrente.
Outros tipos de voltamperometria podem ser inferidos a partir deste gráfico, modificando a onda potencial. t Pulso potencial repentino seguindo certos padrões. Cada padrão está associado a um tipo de voltamperometria e abrange sua própria teoria e condições experimentais.
Voltamperometria de pulso
Neste tipo de voltamperometria, você pode analisar misturas de dois ou mais analitos cujo e e e1/2 estão muito próximos um do outro.
Assim, um analito com e1/2 de 0.04V pode ser identificado na companhia de outro com um e1/2 de 0.05V. Enquanto em voltamperometria de varredura linear, a diferença deve ser maior que 0.2V.
Portanto, há maior sensibilidade e limites de detecção mais baixos; isto é, os analitos podem ser determinados em concentrações muito baixas.
Ondas em potencial podem ter padrões semelhantes às escadas, escadas inclinadas e triângulos. O último corresponde à voltamperometria cíclica (CV).
Pode atendê -lo: reagente limitante e excessivoNo CV, um potencial e se aplica em certo sentido, positivo ou negativo e, em seguida, em um certo valor de e em um tempo, o mesmo potencial, mas no sentido oposto é re -aplicado. Ao estudar os voltampeogramas gerados, os máximos revelam a presença de intermediários em uma reação química.
Redisolution voltamperometria
Isso pode ser do tipo anódico ou catódico. Consiste na eletrodeposição do analito em um eletrodo de mercúrio. Se o analito é um íon metálico (como o CD2+), uma amálgama será formada; E se é um ânion (como Moo42-), um sal de mercúrio insolúvel.
Em seguida, pulsos em potencial são aplicados para determinar a concentração e identidade das espécies de eletrodepos. Assim, o amálgama é redisuelve, assim como os sais de mercúrio.
Aplicações de Voltamperometria
- A voltamperometria anódica da redisolução é usada para determinar a concentração de metais dispensados por fluido.
- Permite estudar a cinética dos processos redox ou de adsorção, especialmente quando os eletrodos são modificados para detectar um analito específico.
- Sua base teórica serviu para a fabricação de biossensores. Com estes, a presença e a concentração de moléculas biológicas, proteínas, gorduras, açúcares etc. podem ser determinados.
- Finalmente, detecta a participação de intermediários nos mecanismos de reação.
Referências
- González m. (2010). Voltamperometria. Recuperado de: química.LaGuia2000.com
- Química e Ciência (2011). Voltamperometria. Recuperado de: thequimica andlaciencia.Blogspot.com
- Quiroga a. (2017). Voltametria cíclica. Recuperado de: química.Librettexts.org
- Samuel p. Kouves (s.F.). Técnicas voltamétricas. [PDF]. Universidade Tufts. Recuperado de: marrom.Edu
- Dia r. & Underwood a. Química analítica quantitativa (Quinta ed.). Pearson Prentice Hall.

