Características da Valina, funções, alimentos ricos, benefícios
- 2129
- 207
- Terrell Stokes
O Valina Pertence aos 22 aminoácidos identificados como os componentes "básicos" das proteínas; É identificado com o acrônimo "val" e com a letra "v". Este aminoácido não pode ser sintetizado pelo corpo humano, portanto, é catalogado no grupo de nove aminoácidos essenciais para os humanos.
Muitas proteínas globulares têm um interior rico em resíduos de valina e leucina, pois ambos são associados por interações hidrofóbicas e são indispensáveis para a dobra da estrutura e a conformação tridimensional de proteínas.
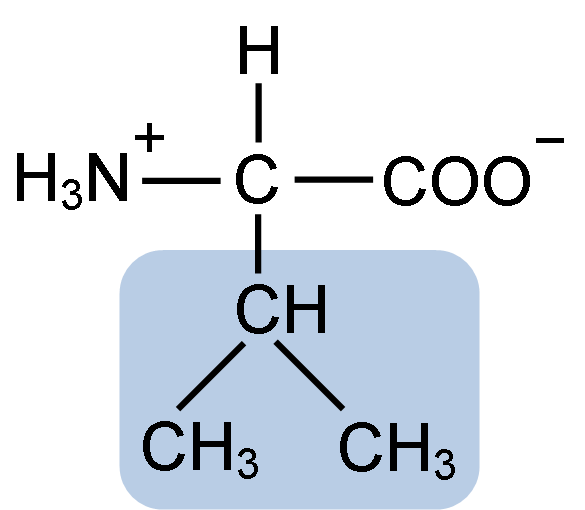
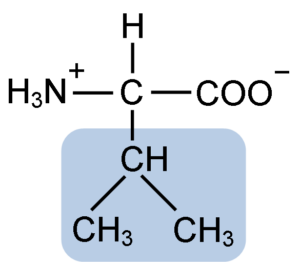 Estrutura química da valina de aminoácidos (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura química da valina de aminoácidos (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) La Valina foi purificada pela primeira vez em 1856 por V. Grup-Besanez de um extrato aquoso do pâncreas. No entanto, o nome "valina" foi cunhado por e. Fisher em 1906, quando ele conseguiu sintetizá -lo artificialmente e observou que sua estrutura era muito semelhante à do ácido valoroso, encontrado em plantas comumente conhecidas como "Valerianas".
A valina é um dos aminoácidos encontrados em posições preservadas em certas proteínas compartilhadas pelos vertebrados, por exemplo, na posição 80 de citocromo c de vertebrados são leucina, valina, isoleucina e métodina na mesma ordem na mesma ordem.
Em tecidos ou biomateriais com características resistentes, duras e elásticas, como ligamentos, tendões, vasos sanguíneos, fios ou web, existem grandes quantidades de valina, o que fornece flexibilidade e resistência graças às suas interações hidrofóbicas com outros aminoácidos.
A substituição de um resíduo de glutamato por uma valina na cadeia β de hemoglobina, a proteína responsável pelo transporte de oxigênio pelo sangue causa má formação na estrutura da proteína, o que causa hemoglobina "s".
Esta mutação produz anemia ou drepanocitose falciforme, uma condição patológica na qual os glóbulos vermelhos adquirem uma forma de HOZ crescente ou característico, que os diferencia da aparência normal, arredondada e achatada.
Atualmente, alguns dos herbicidas mais utilizados têm compostos ativos para sulfonilureia e metilsulfometuron, que causam danos à enzima acetolactato sintase, necessária para a primeira etapa da síntese da valina, leucina e isoleucina. Os danos causados por esses pesticidas evitam ervas e ervas daninhas normalmente podem se desenvolver.
[TOC]
Caracteristicas
Valina é um aminoácido com um esqueleto de cinco carbonas e pertence ao grupo de aminoácidos com correntes laterais alifáticas. Seu caráter hidrofóbico é tal que pode ser comparado ao da fenilalanina, a da leucina e da isoleucina.
Os aminoácidos que possuem cadeias de hidrocarbonetos em suas cadeias rm ou laterais são comumente conhecidas na bibliografia como aminoácidos de cadeia ramificados ou ramificados. Neste grupo, são valinos, fenilalanina, leucina e isoleucina.
Geralmente, os aminoácidos desse grupo são usados como elementos estruturais internos na síntese de proteínas, pois estes podem estar associados entre si por meio de interações hidrofóbicas, "fugindo" da água e estabelecendo a dobra estrutural característica de muitas proteínas.
Seu peso molecular é de cerca de 117 g/mol e, uma vez que seu grupo de cadeia l lateral ou é um hidrocarboneto ramificado, ele não tem carga e sua abundância relativa em estruturas de proteínas é pouco maior que 6%.
Estrutura
La Valina compartilha a estrutura geral e os três grupos químicos típicos de todos os aminoácidos: o grupo carboxil (COOH), o grupo amino (NH2) e um átomo de hidrogênio (-h). Em seu grupo de cadeia r ou lateral, possui três átomos de carbono que oferecem características muito hidrofóbicas.
Pode servir a você: seres inertes: características, exemplos, diferenças com seres vivosComo é verdade para todos os compostos químicos classificados como "aminoácidos", a valina possui um átomo de carbono central que é quiral e que é conhecido como α carbono, ao qual os quatro grupos químicos mencionados.
O nome da IUPAC da valina é 2-3-amino-3-butanóic.
Todos os aminoácidos podem ser encontrados na forma d ou l e a valina não é exceção. No entanto, a forma de valor L é muito mais abundante que a forma D-valleine e, além disso, é espectroscopicamente mais ativa que a forma D.
L-valor é a forma usada para a formação de proteínas celulares e, portanto, é, dos dois, a forma biologicamente ativa. Ele cumpre funções como nutracêutico, micronutriente para plantas, metabólito para humanos, algas, leveduras e bactérias, entre muitas outras funções.
Funções
Valina, apesar de ser um dos nove aminoácidos essenciais, não desempenha um papel adicional em sua participação na síntese de proteínas e como um metabolito em sua própria rota de degradação.
No entanto, aminoácidos volumosos, como valina e tirosina, são responsáveis pela flexibilidade da fibroína, o principal componente de proteína dos fios de seda produzidos pelas espécies da espécie Bombyx Mori, comumente conhecido como vermes de seda ou amoreira.
Tecidos como ligamentos sanguíneos arteriais e óculos são compostos por uma proteína fibrosa conhecida como elastina. Isso consiste em cadeias polipeptídicas com seqüências repetidas de glicina, alanina e aminoácidos valinos, o resíduo mais importante com proteína.
Valina participa das principais rotas de síntese dos compostos responsáveis pelo cheiro característico de frutas. Moléculas de valina são transformadas em derivados metilados e ramificados de ésteres e álcoois.
Na indústria de alimentos
Existem muitos aditivos químicos que usam valina em combinação com glicose para obter odores apetitosos em certos preparativos culinários.
A uma temperatura de 100 ° C, esses aditivos têm um cheiro característico de centeio e mais de 170 ° C cheiro em chocolate quente, por isso são populares na produção de alimentos na indústria de padeiro e pastelaria (massa).
Esses aditivos químicos usam L-valina sintetizada artificialmente.
Biossíntese
Todos os aminoácidos de cadeia ramificados, como valina, leucina e isoleucina, são sintetizados principalmente em plantas e bactérias. O que significa que animais como ser humano e outros mamíferos precisam ingerir alimentos ricos nesses aminoácidos para poder atender aos seus requisitos nutricionais.
Geralmente, a biossíntese da valina começa com a transferência de dois átomos de carbono do pirofosfato hidroxietil -tipinamina para o piruvato pela ação da enzima oceto -hidroxi -isomer ácido ácido ácido ácido.
Os dois átomos de carbono derivam de uma segunda molécula de piruvato através de uma reação dependente de TPP muito semelhante à catalisada pelo piruvato de discarboxilase da enzima, mas que é catalisado por di-hidroxi-ácido desidratase.
A enzima valina aminotransferase, finalmente, incorpora um grupo amino ao composto cetoácido resultante da descarboxilação anterior, que forma o L-valina. A leucina, a isoleucina e os aminoácidos valinos têm uma grande similaridade estrutural, e isso ocorre porque muitos intermediários e enzimas compartilham em suas rotas biossintéticas.
Pode atendê -lo: flora e fauna de salta: espécies mais representativasO cetoácido produzido durante a biossíntese do L-Valina regula algumas etapas enzimáticas por feedback negativo ou regulação alostérica na via biossintética da leucina e outros aminoácidos relacionados.
Isso significa que as rotas biossintéticas são inibidas por um metabolito gerado nelas que, quando acumulado, fornece às células um sinal específico que lhes diz que um certo aminoácido é excessivamente e, portanto, sua síntese pode parar.
Degradação
As três primeiras etapas de degradação da valina são compartilhadas na rota de degradação de todos os aminoácidos de cadeia ramificados.
Valina pode entrar no ciclo do ácido cítrico de Krebs a ser transformado em succinil-coa. A rota de degradação consiste em uma transaminação inicial, catalisada por uma enzima conhecida como aminotransferase de aminoácidos de cadeia ramificada (BCAT).
Esta enzima catalisa uma transaminação reversível que consegue converter os aminoácidos de cadeia ramificada em sua cadeia ramificada correspondente α-zo-stoats.
Nesta reação, a participação do torque de glutamato/2-zotoglutarato é essencial, uma vez que o 2-zotoglutarato recebe o grupo amino que é removido do aminoácido que está sendo metabolizado e se torna glutamato.
Esta primeira etapa da reação do catabolismo da valina produz o 2-ceticoisavalerato e é acompanhada pela conversão de 5'-fosfato piridoxal (PLP) em piridoxamina 5'-fosfato (PMP).
Em seguida, o 2-cetomalato é usado como um substrato de um complexo enzimático mitocondrial, conhecido como α-α-zo-gotes de cadeia ramificada, que adiciona uma porção de coash e forma o isobutiril-CoA, que é subsequentemente desidrogenado e transformado em metacrililil -Coa.
O Metacrylil-CoA é processado a jusante em 5 etapas enzimáticas adicionais que envolvem hidratação, eliminação da porção de Coash, oxidação, adição de outra porção de COASH e reorganização molecular, que terminam com a produção de succinil-CoA, que entra imediatamente no ciclo de Krebs.
Alimentos ricos em valina
As proteínas contidas nas sementes de gergelim ou gergelim são ricas em valina, com quase 60 mg do aminoácido para cada grama de proteína. Por esse motivo, biscoitos, biscoitos e bares de gergelim ou nougat são recomendados para crianças com dietas deficientes deste aminoácido.
Os grãos de soja, em geral, são ricos em todos os aminoácidos essenciais, mesmo em Valina. No entanto, eles são pobres em meionina e cisteína. A textura de proteína ou soja tem estruturas quaternárias muito complexas, mas que são fáceis de dissolver e separar em subunidades menores na presença de sucos gástricos.
A caseína, que normalmente está em leite e seus derivados, é rica em sequências repetidas de Valina. Como a soja, esta proteína é facilmente degradada e absorvida no trato intestinal de mamíferos.
Estima -se que para cada 100 gramas de proteína de soja, cerca de 4,9 gramas de valina sejam ingeridos; Enquanto para cada 100 ml de leite, cerca de 4,6 ml de valina são ingeridos.
Outros alimentos ricos em referidos aminoácidos são carne bovina, peixe e vários tipos de vegetais e vegetais.
Benefícios da sua ingestão
A valina, como uma grande parte dos aminoácidos, é um aminoácido glicogênico, ou seja, pode ser incorporado à rota gluconeogênica, e muitos neurologistas afirmam que sua ingestão ajuda a manter a saúde mental, a coordenação muscular e reduzir o estresse.
Pode atendê -lo: os 5 ramos da principal biotecnologiaMuitos atletas consomem comprimidos compactados em Valina, pois ajudam a regeneração de tecidos, especialmente os tecidos musculares. Ser um aminoácido capaz de se juntar à gliconeogênese ajuda a produção de energia, o que não é apenas importante para a atividade física, mas para o funcionamento nervoso.
Os alimentos da Valina ajudam a manter o equilíbrio de compostos de nitrogênio no corpo. Esse equilíbrio é essencial para a geração de energia das proteínas ingeridas, para crescimento corporal e cura.
Seu consumo evita danos ao fígado e à vesícula biliar, além de contribui para a otimização de muitas funções do corpo.
Um dos suplementos alimentares mais populares entre atletas para aumentar o volume muscular e a recuperação muscular é BCAA.
Esses tipos de comprimidos consistem em comprimidos com misturas de diferentes aminoácidos, dentre os quais geralmente incluem aminoácidos como L-valina, L-isoleucina e L-leucina; Eles também são ricos em vitamina B12 e outras vitaminas.
Algumas experiências com porcos mostraram que os requisitos de valina são muito mais altos e mais limitantes para as mães durante o estágio de amamentação, uma vez que esse aminoácido ajuda a secretar o leite e produz melhorias na taxa de crescimento de recém -nascidos infantis.
Distúrbios de deficiência
A ingestão diária de valina recomendada para bebês é de cerca de 35 mg para cada grama de proteína consumida, enquanto para adultos a quantidade é um pouco menor (cerca de 13 mg).
A doença mais comum relacionada ao valino e outros aminoácidos de cadeia ramificada é conhecida como "doença da urina com xarope de arce" ou "cetoacidúria".
Esta é uma condição hereditária causada por um defeito nos genes que codificam as enzimas desidrogênicas dos α-zoacides derivados da leucina, isoleucina e valina, necessários para metabolizá-los.
Nesta doença, o organismo não pode assimilar nenhum desses três aminoácidos quando são obtidos da dieta; portanto, os cetoácidos derivados se acumulam e são expulsos na urina (eles também podem ser detectados no soro do sangue e no líquido cerebropinhal).
Por outro lado, uma dieta ruim em Valina tem sido relacionada a patologias neurológicas, como a epilepsia. Também pode causar perda de peso, a doença de Huntington e pode até acabar no desenvolvimento de certos tipos de câncer, uma vez que o sistema de reparo de tecidos e a síntese de biomoléculas são comprometidos.
Referências
- Abu-Baker, s. (2015). Revisão da bioquímica: conceitos e conexões
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Plimmer, r. H. PARA., & Phillips, H. (1924). A análise de proteínas. Iii. Estimativa de histidina e tirosina por bomba. Biochemical Journal, 18 (2), 312
- Plimmer, r. H. PARA. (1912). A constituição química das proteínas (vol. 1). Longmans, verde.
- Torii, k. PARA. Z. OU. QUALQUER., E Iitaka, e. (1970). A estrutura cristalina de L-valina. Crystalographica Seção B: Cristalografia Estrutural e Crystal Chemistry, 26 (9), 1317-1326.
- Tosti, v., Bertozzi, b., & Fontana, L. (2017). Benefícios para a saúde da dieta mediterrânea: mecanismos metabólicos e moleculares. The Journals of Gerontology: Série A, 73 (3), 318-326.
- « Fórmulas de energia gravitacional, características, aplicações, exercícios
- As 115 melhores frases sobre elegância »

