Características, estrutura, funções e testes de troponina
- 3579
- 584
- Alfred Kub
Troponina É o nome que recebe uma proteína presente no músculo esquelético e cardíaco dos vertebrados, associado aos filamentos nas fibras musculares e que tem funções na regulação da atividade contrátil (contração e relaxamento muscular).
As fibras musculares são as células que compõem o tecido muscular, cuja capacidade de contração é baseada na interação entre os filamentos que são ordenados e intimamente associados, ocupando a maior parte do volume citoplasmático.
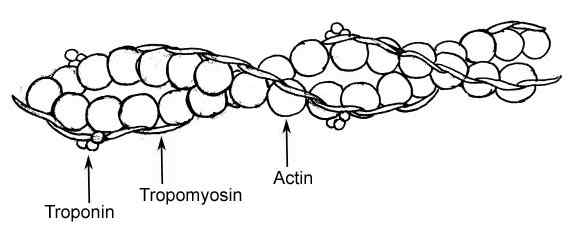 Representação gráfica dos elementos de um filamento fino em fibras musculares (Fonte: Raul654, via Wikimedia Commons)
Representação gráfica dos elementos de um filamento fino em fibras musculares (Fonte: Raul654, via Wikimedia Commons) Esses filamentos são conhecidos como miofilamentos e há duas classes: a espessura e a fina. Filamentos espessos são compostos de moléculas de miosina II, enquanto os filamentos finos são actina globular ou polímeros de actina G associados com duas outras proteínas.
Tanto a actina quanto a miosina também são encontradas em outras células do corpo humano e de outros organismos, apenas em muito menos proporção e participando de diferentes processos, como migração celular, exocitose, na citocinese (durante a divisão celular) e uniforme no tráfego vesicular intracelular.
Troponina e tropomiosina são as duas proteínas associadas a filamentos finos de actina que participam da regulação dos processos de contração e relaxamento das miofibrilas de células musculares ou fibras.
Os mecanismos de ação através dos quais essas duas proteínas exercem sua função estão relacionadas à concentração intracelular de cálcio. O sistema de regulação da troponina é um dos sistemas mais conhecidos da fisiologia e bioquímica da contração muscular esquelética.
Essas proteínas são de grande importância para o corpo. Atualmente, é conhecido com certeza que algumas cardiomiopatias familiares ou congênitas são o produto de mutações na sequência dos genes que eles codificam (troponina ou tropomiosina).
[TOC]
Caracteristicas
A troponina está associada à actina de filamentos finos de fibras musculares no músculo esquelético e cardíaco em uma proporção estequiométrica de 1 a 7, ou seja, uma molécula de troponina para cada 7 moléculas de actina.
Esta proteína, como estressada, é encontrada exclusivamente nos filamentos contidos dentro das miofibrilas das fibras musculares estriadas esqueléticas e cardíacas, e não nas fibras musculares lisas que compõem os músculos vasculares e viscerais.
É concebido por alguns autores, como a proteína reguladora da tropomiosina. Assim, possui sites de sindicatos para interação com moléculas de actina, o que lhe dá a capacidade de regular sua interação com a miosina de filamentos grossos.
Pode atendê -lo: aldohexosa: estrutura e exemplos molecularesNos miofilamentos, a relação entre as moléculas de troponina e tropomiosina é de 1 a 1, o que significa que, para cada complexo de troponina que existe, existe uma molécula de tropomiosina associada a isso.
Estrutura
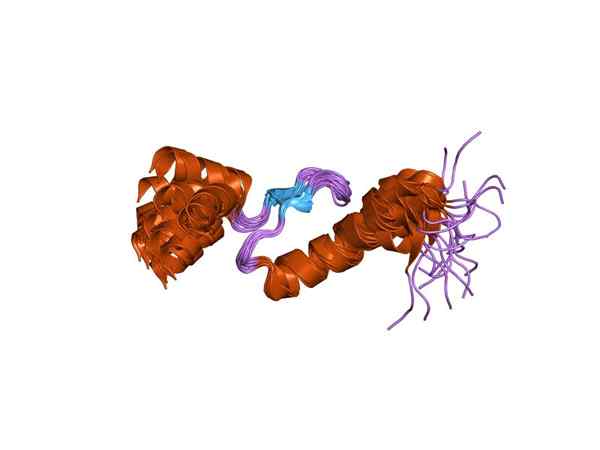
A troponina é um complexo proteico composto por três subunidades globulares diferentes conhecidas como troponina I, troponina C e troponina T, que juntas somam, mais ou menos, 78 kDa.
No corpo humano, existem variantes específicas de tecido para cada uma dessas subunidades, que diferem entre si no nível genético e molecular (com relação aos genes que os codificam), como no nível estrutural (em relação ao seu aminoácido sequências).
 Representação de uma das subunidades da troponina (fonte: Jawahar Swaminathan e funcionários do MSD do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons)
Representação de uma das subunidades da troponina (fonte: Jawahar Swaminathan e funcionários do MSD do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons) Towonin C ou TNC é o menor das três subunidades e talvez uma das mais importantes. Possui peso molecular de 18 kDa e sites para ingressar em cálcio (Ca2+).
T ou TNT troponina é aquele que tem os locais da união para ancorar o complexo das três subunidades à tropomiosina e possui 30 kDa de peso molecular; Também é conhecido como T -Subunidade ou junção tropomiosina.
A troponina I ou TNI, de pouco mais de 180 resíduos de aminoácidos, tem o mesmo peso molecular que a troponina T, mas em sua estrutura tem locais especiais para se juntar à actina, bloqueando a interação entre a última e a miosina, que é o fenômeno responsável Para a contração das fibras musculares.
Muitos livros didáticos se referem a esta subunidade, como subunidade inibitória e como a "pasta" molecular entre as três subunidades da troponina. Sua capacidade de união de actina e sua atividade inibitória é aprimorada por sua associação com tropomiosina, mediada pela subunidade TNT.
Foi demonstrado que, na subunidade I, a região da sequência encarregada da inibição é definida por um peptídeo central de 12 resíduos de aminoácidos entre as posições 104 e 115; e que a região do terminal C da subunidade também tem uma função durante a inibição.
Funções
A principal função da troponina na contração muscular depende de sua capacidade de ingressar no cálcio, uma vez que esta proteína é o único componente de filamentos finos no músculo estriado que essa propriedade possui.
Na ausência de troponina, os filamentos finos são capazes de unir filamentos grossos e contratar, independentemente da concentração intracelular de cálcio, portanto, a função da troponina é evitar a contração na ausência de cálcio através de sua associação com tropomiosina.
Pode atendê -lo: ovuliparosAssim, a troponina desempenha um papel importante na manutenção do relaxamento muscular quando não há cálcio intracelular suficiente e na contração muscular quando o estímulo elétrico nervoso permite a entrada de cálcio na fibra muscular.
Como isso acontece?
Nos músculos estriados esqueléticos e cardíacos, a contração muscular ocorre graças à interação entre filamentos finos e grossos que deslizam um sobre o outro.
Nas células desses músculos, o cálcio é essencial para a interação de vulossina de ação (filamentos finos e espessos), uma vez que os locais da união da actina para a miosina estão "ocultos" pela ação conjunta da tropomiosina e da troponina, que é o que responde para cálcio.
Os íons cálcio que são provenientes do retículo sarcoplasmático (o retículo endoplasmático das fibras musculares) se ligam à subunidade C da troponina, que neutraliza a inibição mediada pela troponina e a contração muscular é desencadeada.
A "neutralização" da inibição causada pela subunidade I ocorre após a união do cálcio à subunidade C, que gera uma mudança conformacional que se espalha entre as três subunidades e permite sua dissociação de moléculas de actina e tropomiosina.
Essa dissociação entre troponina, tropomiosina e actina expõe no actina os sites da união para miosina. É então que as cabeças globulares deste último podem interagir com as fibras de actina e iniciar a contração dependente de ATP devido ao deslocamento de um filamento sobre o outro.
Teste de troponina
A troponina é o biomarcador preferido para a detecção de lesões cardíacas. Portanto, o teste de troponina é amplamente utilizado no diagnóstico bioquímico, precoce e/ou preventivo, de algumas condições patológicas cardíacas, como infarto agudo do miocárdio.
Muitos médicos de tratamento consideram que esse teste facilita a tomada de decisão em relação ao que fazer e que tratamento para administrar pacientes que têm dor no peito.
Em geral, está relacionado à detecção de t e I subunidades da troponina, uma vez que a figura de troponina C também é encontrada nos músculos esqueléticos da lenta contração; isto é, não é específico para o coração.
Qual é o teste de troponina baseado?
O teste de troponina é geralmente um estudo imune que detecta isoformas cardíacas de T e I subunidades de troponina. Então, baseia -se nas diferenças que existem entre ambas as isoformas.
Pode atendê -lo: síntese de proteínasISOFORMA DA SUBUNIT DE TOPONINA I (CTNI) (CTNI)
No tecido muscular do miocárdio, existe apenas uma isoforma da subunidade I da troponina, caracterizada pela presença de uma "cauda" pós-translacional de 32 aminoácidos em seu final N-terminal.
Esta isoforma é detectada graças ao desenvolvimento de anticorpos monoclonais específicos que não reconhecem outras isoformas não cardíacas, uma vez que a cauda de aminoácidos é mais ou menos 50% diferente das extremidades de outras isoformas.
O CTNI não é expresso em tecidos danificados, mas é exclusivo para tecido cardíaco adulto.
ISOFORMA DA SUBUNIT DE TROPONINA T (CTNT) (CTNT)
A isoforma cardíaca da subunidade da troponina é codificada em três genes diferentes, cujo ARNM pode sofrer cortes e emendas alternativas que resultam na produção de isoformas com sequências variáveis nas extremidades N e C-terminais.
Embora o músculo cardíaco dos seres humanos contenha 4 isoformas TNT, apenas uma é uma característica do tecido cardíaco de um adulto. Isso é detectado com anticorpos específicos projetados contra o extremo N-terminal de sua sequência aminooacida.
Os testes de “nova geração” para a subunidez t da isoforma cardíaca prestam muita atenção ao fato de que algum tecido esquelético ferido pode reexpreter essa isoforma, para que as reações cruzadas possam ser obtidas com os anticorpos.
Referências
- Babuin, l., & Jaffe, um. S. (2005). Troponina: o biomarcador de escolha para a detecção de lesão cardíaca. Cmaj, 173(10), 1191-1202.
- Collinson, p., Stubbs, p., & Kessler, um.-C. (2003). Avaliação multicêntrica do valor diagnóstico da troponina T cardíaca, massa CK-MB e mioglobina para avaliar pacientes com suspeita de síndromes coronarianas agudas na prática clínica de rotina. Coração, 89, 280-286.
- Farah, c., & Reinach, f. (novecentos e noventa e cinco). O complexo de troponina e a regulação da contração muscular. Faseb, 9, 755-767.
- Keller, t., Peetz, d., Tzikas, s., Roth, a., Czyz, e., Bickel, c.,... Blankenberg, S. (2009). Ensaio sensível de troponina I no diagnóstico precoce de inflação miocárdica aguda. O novo jornal inglês de medicina, 361(9), 868-877.
- Ross, m., & Pawlina, w. (2006). Histologia. Um texto e atlas com células correlacionadas e biologia molecular (5ª ed.). Lippinott Williams & Wilkins.
- Wakabayashi, t. (2015). Mecanismo de regulação de cálcio da contração muscular. Em busca de sua base estrutural. Proc. Jpn. Acade. Ser. B, 91, 321-350.
- « Características, estrutura e funções da tropomiosina
- Conceito de calor sensível, fórmulas e exercícios resolvidos »

