Estrutura de trioxido de enxofre (SO3), propriedades, riscos, usos
- 2222
- 41
- Terrence King IV
Ele Trióxido de enxofre É um composto inorgânico formado pela união de um (s) átomo (s) de enxofre e 3 átomos de oxigênio (O). Sua fórmula molecular é tão3. À temperatura ambiente, o SO3 É um líquido que emite gases no ar.
A estrutura do SO3 Gasoso é plano e simétrico. Os três oxigênio estão localizados equitativamente ao redor do enxofre. O então3 Reage violentamente com água. A reação é exotérmica, o que significa que o calor é produzido, em outras palavras, muito é aquecido.
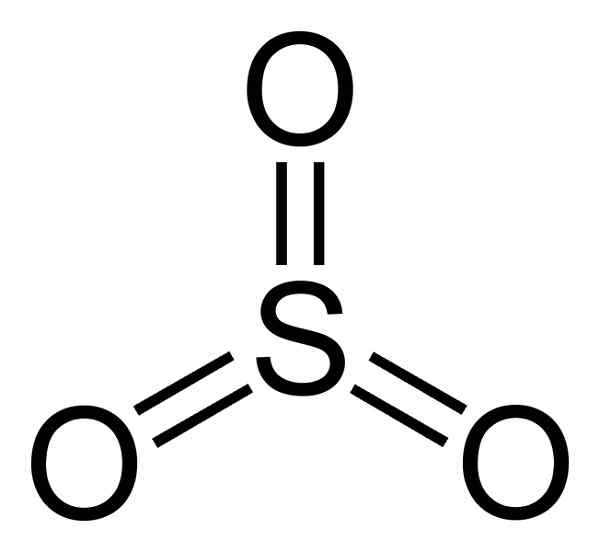
 Molécula de trióxido de enxofre3. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Molécula de trióxido de enxofre3. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. Quando o SO3 O líquido esfria, torna -se um sólido que pode ter três tipos de estrutura: alfa, beta e gama. O mais estável é o alfa, na forma de camadas juntas, constituindo uma rede.
O trióxido de enxofre gasoso é usado para preparar o ácido sulfúrico, também chamado de óleo, devido à sua semelhança de petróleo ou substância oleosa. Outra de suas aplicações importantes está no sulfonação de compostos orgânicos, ou seja, a adição de grupos -então3- para estes. Assim, produtos químicos úteis podem ser preparados, como detergentes, corantes, pesticidas, entre muitos outros.
O então3 É muito perigoso, pode causar graves queimaduras, olhos e danos na pele. Tampouco deve ser inalado ou ingerido porque pode causar morte por queimaduras internas, na boca, esôfago, estômago, etc.
Por esses motivos, deve ser manipulado com grande cautela. Você nunca deve entrar em contato com água ou materiais combustíveis, como madeira, papel, tecidos, etc., Bem, o fogo pode ser produzido. Nem deve ser descartado ou esgoto devido ao perigo de explosão.
O então3 O gasoso gerado em processos industriais não deve ser liberado para o meio ambiente, pois é um dos responsáveis pela chuva ácida que já prejudicou grandes extensões de florestas no mundo.
[TOC]
Estrutura
A molécula de trióxido de enxofre3 No estado gasoso, ele tem uma estrutura triangular plana.
Isso significa que tanto o enxofre quanto o oxigênio são encontrados no mesmo plano. Além disso, a distribuição de oxigênio e todos os elétrons é simétrica.
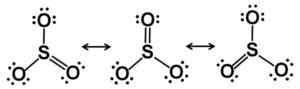 LEWIS RESONANCE STARCUTURES. Os elétrons são distribuídos de forma equitativa no SO3. Autor: Marilú Stea.
LEWIS RESONANCE STARCUTURES. Os elétrons são distribuídos de forma equitativa no SO3. Autor: Marilú Stea. No estado sólido, três tipos de estrutura SO são conhecidos3: Alfa (α-so3), beta (β-so3) e gama (γ-so3).
A forma gama γ-so3 contém aparadores cíclicos, ou seja, três unidades de3 juntos, formando uma molécula cíclica ou em forma de anel.
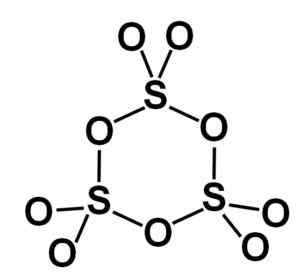 Molécula de anel do tipo de trióxido de enxofre sólido gama. Autor: Marilú Stea.
Molécula de anel do tipo de trióxido de enxofre sólido gama. Autor: Marilú Stea. A fase beta β-so3 Possui infinitas cadeias helicoidais de composição tetraedra4 unidos uns com os outros.
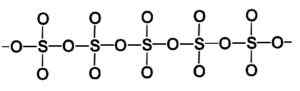 Estrutura de um sólido tipo trióxido de enxofre beta. Autor: Marilú Stea.
Estrutura de um sólido tipo trióxido de enxofre beta. Autor: Marilú Stea. A maneira mais estável é alfa α-so3, semelhante à beta, mas com uma estrutura de camada, com as redes unidas formando uma rede.
Nomenclatura
-Trióxido de enxofre
-Anidrido sulfúrico
-Óxido sulfúrico
-SW3 Gama, γ-so3
-SW3 Beta, β-so3
-SW3 Alfa, α-SO3
Propriedades físicas
Estado físico
À temperatura ambiente (cerca de 25 ºC) e pressão atmosférica, o SO3 É um líquido incolor que emite fumaça no ar.
Quando o SO3 O líquido é puro a 25 ºC é uma mistura de So3 monomérico (uma única molécula) e trimérico (3 moléculas ligadas) de fórmula s3QUALQUER9, também chamado de isso3 Gama γ-so3.
Pode servir a você: Rankine Scale: O que é, conversões, exemplosAo diminuir a temperatura, se o So3 É puro quando atinge 16,86 ºC, solidifica ou congela γ-so3, Também chamado de "So Ice3".
Se contiver pequenas quantidades de umidade (mesmo traços ou quantidades extremamente pequenos)3 Polimeriza o beta β-so3 que forma cristais com um brilho sedoso.
Então mais sindicatos são formados pela geração da estrutura α-SO3, que é um sólido cristalino na forma de agulhas que se assemelham ao amianto ou amianto.
Quando o alfa e a beta derreter geram gama.
Peso molecular
80,07 g/mol
Ponto de fusão
SW3 Gama = 16,86 ºC
Ponto Triplo
É a temperatura em que os três estados físicos estão presentes: sólido, líquido e gasoso. Na forma alfa, o ponto triplo está em 62,2 ºC e na versão beta está a 32,5 ºC.
Ao aquecer a forma alfa, isso tem uma tendência maior de subliminar do que derreter. Sublimimar significa passar do estado sólido para o refrigerante diretamente, sem passar pelo estado líquido.
Ponto de ebulição
Todas as formas de So3 Ferva a 44,8 ºC.
Densidade
O então3 Liquid (gama) tem uma densidade de 1.9225 g/cm3 A 20 ºC.
O então3 Gaseous tem uma densidade de 2,76 em relação ao ar (ar = 1), indicando que é mais pesado que o ar.
Pressão de vapor
SW3 ALFA = 73 mm Hg a 25 ºC
SW3 beta = 344 mm Hg a 25 ° C
SW3 Gama = 433 mm Hg a 25 ºC
Isso significa que a forma gama tende a evaporar mais facilmente do que a versão beta e isso que o alfa.
Estabilidade
A forma alfa é a estrutura mais estável, os outros são metaestáveis, ou seja, eles são menos estáveis.
Propriedades quimicas
O então3 reage energicamente com água para dar ácido sulfúrico H2SW4. Ao reagir, há muito calor para que o vapor de água seja rapidamente destacado da mistura.
Sendo exposto ao ar o SO3 absorver a umidade rapidamente, emitindo vapores densos.
É um agente desidratante muito forte, isso significa que elimina a água facilmente de outros materiais.
O enxofre do SO3 Ele tem uma afinidade por elétrons livres (ou seja, elétrons que não estão em uma ligação entre dois átomos), portanto, tende a formar complexos com compostos que os possuem, como piridina, trimetilamina ou dioxano.
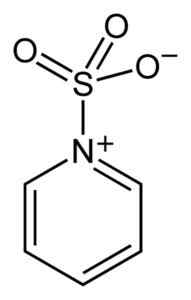 Complexo entre o trióxido de enxofre e a piridina. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Complexo entre o trióxido de enxofre e a piridina. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Ao formar complexos, o enxofre tomou emprestado os elétrons do outro composto para satisfazer sua falta destes. O trióxido de enxofre ainda está disponível nesses complexos, que são usados em reações químicas para fornecer assim3.
É um poderoso reagente sulfonante de compostos orgânicos, o que significa que ele serve para adicionar facilmente um grupo -então3- Para as moléculas.
Reage facilmente com os óxidos de muitos metais para dar sulfatos desses metais.
É corrosivo para metais, tecidos de animais e vegetais.
O então3 É um material difícil de manusear por vários motivos: (1) seu ponto de ebulição é relativamente baixo, (2) tende a formar polímeros sólidos a temperaturas inferiores a 30 ºC e (3) tem uma alta reatividade em relação a quase todas as substâncias orgânicas E a água.
Pode servir a você: sólidos amorfos: estrutura, propriedades, exemplosEle pode polimerizar explosivamente se não conter um estabilizador e há presença de umidade. Como estabilizadores, dimetilsulfato ou óxido de boro são usados.
Obtenção
É obtido pela reação a 400 ºC entre o dióxido de enxofre, então2 e oxigênio molecular ou2. No entanto, a reação é muito lenta e os catalisadores são necessários para aumentar a velocidade disso.
2 Então2 + QUALQUER2 ⇔ 2 Então3
Entre os compostos que aceleram essa reação estão o Platino Metal Pt, o pentóxido de vanádio V2QUALQUER5, Óxido férrico2QUALQUER3 e óxido nítrico.
Formulários
Na preparação do petróleo
Uma de suas principais aplicações consiste na preparação de óleo ou ácido sulfúrico, chamado porque emite vapores visíveis a olho nu. Para obtê -lo, o SO é absorvido3 Em ácido sulfúrico concentrado H2SW4.
 Oleum Pu -Sulfúrico ou fumar. Você pode ver a fumaça branca saindo da garrafa. C. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Oleum Pu -Sulfúrico ou fumar. Você pode ver a fumaça branca saindo da garrafa. C. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Isso é feito em torres especiais de aço inoxidável, onde o ácido sulfúrico concentrado (que é líquido)3 Gases está subindo.
Líquido e gás entram em contato e se juntam, formando o oleo que é um líquido de aparência oleosa. Isso tem uma mistura de h2SW4 Eu sou3, Mas também possui moléculas de ácido dissulfúrico H2S2QUALQUER7 e trissulfúrico h2S3QUALQUER10.
Em reações de sulfonação química
A sulfonação é um processo -chave em aplicações industriais de grande escala para a fabricação de detergentes, surfactantes, corantes, pesticidas e produtos farmacêuticos.
O então3 Serve como um agente sulfonante para preparar óleos sulfonados e detergentes alquil-angaromos, entre muitos outros compostos. Abaixo está a reação de sulfonação de um composto aromático:
ARH + SO3 → Arso3H
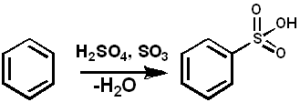 Sulfonação de benzeno com tão3. Pedro8410 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Sulfonação de benzeno com tão3. Pedro8410 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Para reações de sulfonação, ou mais3 na forma de seus complexos com piridina ou trimetilamina, entre outros.
Em extração de metal
Gás s3 Tem sido usado no tratamento de minerais. Óxidos metálicos simples podem se tornar muito mais solúveis em sulfatos ao tratá -los com assim3 a temperaturas relativamente baixas.
Minerais de enxofre como pirita (sulfeto de ferro), trato3 Permite esses metais facilmente e a baixo custo.
Ferro, níquel e sulfídios de cobre reagem com SO Gas3 Mesmo à temperatura ambiente, formando os respectivos sulfatos, que são muito solúveis e podem ser submetidos a outros processos para obter metal puro.
Em vários usos
O então3 Serve para preparar o ácido clorossulfúrico também chamado de ácido clorossulfônico HSO3Cl.
O trióxido de enxofre é um oxidante muito poderoso e é usado na fabricação explosiva.
Riscos
Para a saúde
O então3 É um composto altamente tóxico por todas as rotas, ou seja, inalação, ingestão e contato com a pele.
Irrita e Corrodes mucosas. Causa pele e olhos. Seus vapores são muito tóxicos quando são inalados. Queimaduras internas são produzidas, dificuldade respiratória, dor no peito e edema pulmonar.
Pode atendê -lo: butanona: estrutura, propriedades e usos O trióxido de enxofre SO3 é muito corrosivo e perigoso. Autor: Openicons. Fonte: Pixabay.
O trióxido de enxofre SO3 é muito corrosivo e perigoso. Autor: Openicons. Fonte: Pixabay. É venenoso. Sua ingestão gera queimaduras graves, esôfago e estômago. Além disso, suspeita -se que seja carcinogênio.
Fogo ou explosão
Representa o perigo de incêndio ao entrar em contato com materiais orgânicos como madeira, fibras, papel, óleo, algodão, entre outros, especialmente se estiverem molhados.
Também há risco se você entrar em contato com bases ou agentes reduzidos. É combinado com água explosivamente, formando ácido sulfúrico.
O contato com metais pode produzir gás hidrogênio h2 que é muito inflamável.
Deve ser evitado em vasos de vidro para evitar possível ruptura violenta do contêiner.
Impacto ambiental
O então3 É considerado um dos maiores poluentes presentes na atmosfera da Terra. Isso se deve ao seu papel na formação de aerossóis e sua contribuição para a chuva ácida (devido à formação de ácido sulfúrico H2SW4).
 Floresta danificada pela chuva ácida na República Tcheca. Lovecz [domínio público]. Fonte: Wikimedia Commons.
Floresta danificada pela chuva ácida na República Tcheca. Lovecz [domínio público]. Fonte: Wikimedia Commons. O então3 É formado na atmosfera devido à oxidação do dióxido de enxofre, então2. Quando o assim é formado3 Isso reage rapidamente com a água para formar ácido sulfúrico H2SW4. De acordo com estudos recentes, existem outros mecanismos de transformação SOS3 Na atmosfera, mas devido à grande quantidade de água presente neste, o SO ainda é considerado3 Principalmente convertido em H2SW4.
O então3 resíduos gasosos a gás ou industrial que o contêm não devem ser baixados para a atmosfera, porque é um contaminante perigoso. É um gás extremamente reativo e, como já foi dito acima, na presença de umidade do ar o SO3 Torna -se ácido sulfúrico H2SW4. Portanto, no ar, o SO3 persiste na forma de ácido sulfúrico formando pequenas gotículas ou aerossol.
Se as gotículas de ácido sulfúrico entrarem no trato respiratório do humano ou dos animais, elas crescem rapidamente devido à umidade presente lá, para que tenham a possibilidade de penetrar nos pulmões. Um dos mecanismos pela névoa ácida de H2SW4 (isso é tão3) Pode produzir forte toxicidade é porque o pH extracelular e intracelular dos organismos vivos (plantas, animais e ser humano) muda mudanças).
Segundo alguns pesquisadores, então nevoeiro3 É a causa do aumento de asmáticos em uma área do Japão. A névoa de So3 Ele tem um efeito muito corrosivo nos metais, de modo que as estruturas metálicas construídas pelo ser humano, como algumas pontes e construções, podem ser muito afetadas.
O então3 O líquido não deve ser descartado na drenagem de águas sujas ou esgotos. Se for derramado nos esgotos, você pode criar um perigo de incêndio ou explosão. Se for derramado por acidente, um fluxo de água não deve ser direcionado para o produto. Nunca deve ser absorvido na serragem ou em outro combustível absorvente, pois pode gerar incêndios.
Deve ser absorvido em areia seca, terra seca ou outro absorvente inerte totalmente seco. O então3 Não deve ser derramado no ambiente e nunca deve entrar em contato com isso. Deve ser mantido longe de fontes de água, porque com isso produz ácido sulfúrico que é prejudicial aos organismos aquáticos e terrestres.
Referências
- Sarkar, s. et al. (2019). Influência da amônia e água no destino do trióxido de enxofre na troposfera: pesquisa teórica de ácido sulfâmico e vias de formação de ácido sulfúrico. J Phys Chem A.2019; 123 (14): 3131-3141. NCBI se recuperou.Nlm.NIH.Gov.
- Muller, t.eu. (2006). Ácido sulfúrico e trióxido de enxofre. Enciclopédia Kirk-Othmer. Volume 23. Recuperado da biblioteca online.Wiley.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Enxofre de trióxido. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Kikuchi, r. (2001). Gerenciamento ambiental da imissão de trióxido de enxofre: impacto de SO3 Sobre saúde humana. Gestão Ambiental (2001) 27: 837. Link recuperado.Springer.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Ismail, m.Yo. (1979). Extração de metais de sulfetos usando trióxido de enxofre no leito fluidizado. J. Chem. Tecnologia. Biotechnol. 1979, 29, 361-366. Recuperado da biblioteca online.Wiley.com.
- « Geografia do Malawi Lago, Geologia, Importância, Fauna, Rios
- Estrutura de cianeto de sódio (NACN), propriedades, riscos, usos »

