Estrutura de cianeto de sódio (NACN), propriedades, riscos, usos

- 2455
- 258
- Ernesto Bruen
Ele Cianeto de sódio É um sal inorgânico formado por uma cátion de sódio+ e um ânion cianeto CN-. Sua fórmula química é NACN. Também conhecido como cianeto de sódio, é um sólido cristalino branco. É higroscópico, ou seja, absorve a água do meio ambiente e seus cristais são cúbicos como o nacl de cloreto de sódio.
Ao se dissolver na água, tende a formar cianeto de hidrogênio HCN. Suas soluções dissolvem ouro e prata facilmente. Esse recurso o torna usado para extrair ouro e prata de seus minerais. As soluções usadas para esse fim são recicladas, ou seja, elas são reutilizadas várias vezes.
 Cianeto de sódio de sódio. L26 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Cianeto de sódio de sódio. L26 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. No entanto, algum cianeto consegue escapar de certas lagoas de resíduos, o que representa um perigo para a fauna e o ser humano, porque o cianeto é muito tóxico e pode causar morte.
O NACN é usado na indústria química como intermediário para preparar vários tipos de compostos, como corantes, produtos químicos para agricultura e drogas ou medicamentos.
O cianeto de sódio é um composto muito perigoso, porque pode causar morte, por isso deve ser manipulado com extrema cautela.
[TOC]
Estrutura
O cianeto de sódio é formado por um íon Na+ e um íon CN-.
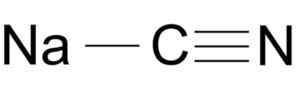 NACN da molécula de cianeto de sódio NACN. Arrowsmaster [Domínio Público], Fonte: Wikimedia Commons.
NACN da molécula de cianeto de sódio NACN. Arrowsmaster [Domínio Público], Fonte: Wikimedia Commons. O íon cianeto tem um carro e um de nitrogênio unido um pelo outro por um link triplo.
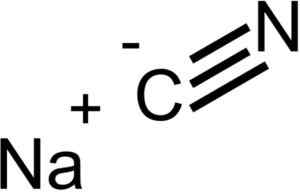 Íons que compõem o cianeto de sódio NACN. EPOP [domínio público]. Fonte: Wikimedia Commons.
Íons que compõem o cianeto de sódio NACN. EPOP [domínio público]. Fonte: Wikimedia Commons. O NACN tem a mesma estrutura cristalina que NaCl, então seus cristais são cúbicos.
Nomenclatura
-Cianeto de sódio
-Cianeto de sódio
Propriedades
Estado físico
Sólido cristalino branco higroscópico (absorve água do meio ambiente).
Peso molecular
49.007 g/mol
Ponto de fusão
563,7 ºC
Ponto de ebulição
1496 ºC
Ponto de inflamação
Não é inflamável. Mas se for exposto a um incêndio, ocorrem cianeto de hidrogênio HCN e óxidos de nitrogênio.
Pode atendê -lo: sublimação: conceito, processo e exemplosDensidade
1.595 g/cm3 A 20 ºC
Solubilidade
Muito solúvel em água: 48 g/100 ml a 10ºC, 82 g/100 ml a 35 ° C. Ligeiramente solúvel em álcool
Constante de dissociação
Está hidrolisado em solução aquosa, gerando cianeto de hidrogênio HCN. A constante desta hidrólise é kh = 2,5 x 10-5.
ph
Soluções aquosas de NACN são fortemente alcalinas
Propriedades quimicas
Ao se dissolver na água, ela se separa em seus íons Na+ e cn-. Em solução aquosa, o cianeto CN CN- Pegue um próton h+ de água h2Ou formando HCN e um Ion OH-, Então a solução se torna alcalina.
Cn- + H2O → hcn + oh-
Por esse motivo, suas soluções aquosas se decompõem rapidamente, mantendo -se armazenado, formando cianeto de hidrogênio HCN.
É corrosivo para o alumínio. Suas soluções dissolvem facilmente a Au e Silver AG na presença de ar.
É um agente quelante porque o ânion cianeto CN- Pode se juntar facilmente a outros metais, como prata, ouro, mercúrio, zinco, cádmio, etc.
Apresenta um cheiro fraco de amêndoas amargas.
Riscos
Deve ser tratado com muito cuidado. É um composto altamente venenoso, inibe processos metabólicos importantes e leva à morte, tanto para ingestão, inalação, absorção da pele ou contato visual.
Se o NACN for inalado, se dissolve na mucosa do trato respiratório e passa para a corrente sanguínea. O íon cianeto de NACN tem uma forte afinidade pelo ferro em um estado de oxidação de +3, ou seja, a fé do cátion férrico3+.
Quando o cianeto é absorvido, reage rapidamente com fé3+ de uma importante enzima das mitocôndrias das células (o citocromo oxidase), impedindo que certos processos de respiração sejam realizados.
Portanto, a respiração celular é inibida ou frenagem e é hipóxia citotóxica. Isso significa que células e tecidos são incapazes de usar oxigênio, especialmente células cerebrais e cardíacas.
Dessa forma, ocorre danos permanentes ou letais ao corpo. Isso pode acontecer em humanos e animais.
Se o congestionamento dos vasos sanguíneos e a corrosão da mucosa gástrica estão ingerindo, além do que já foi mencionado.
Pode atendê -lo: Justus von Liebig O nacn de cianeto de sódio pode causar morte. Autor: Openicons. Fonte: Pixabay.
O nacn de cianeto de sódio pode causar morte. Autor: Openicons. Fonte: Pixabay. Não é combustível, mas em contato com ácidos, libera HCN que é altamente inflamável e tóxico.
Se derreter com nitritos ou cloratos, pode explorar.
Obtenção
Pode ser obtido com NA de sódio, amônia NH3 e carvão c. O sódio reage com a amônia dando nã de sódio2:
2 Na + 2 NH3 → 2 NANH2 + H2↑
A amida de sódio é aquecida com carbono a 600 ºC e produz cianamida de sódio na2NCN, que então com carvão a 800 ° C se torna cianeto de sódio:
2 NANH2 + C → 2 h2↑ + Na2Ncn
N / D2NCN + C → 2 NACN
Outro método é derreter cálcio e cianamida de carvão C com carbonato de sódio na2Co3:
Cancn + c + na2Co3 → Caco3 + 2 NACN
Também pode ser preparado passando o gás nitrogênio n2 Para uma mistura quente de carbonato de sódio2Co3 e carvão c em pó, usando a fé como catalisador ou acelerador da reação:
N / D2Co3 + 4 c + n2 → 2 NACN + 3 CO ↑
Formulários
Na extração de minerais de ouro e prata. Consequências
O cianeto de sódio tem sido usado há muito tempo para extrair metais de ouro e prata de seus minerais.
O cianeto usado no processo é reciclado, mas algo escapa do lago de resíduos junto com os metais pesados não recuperados.
Pássaros, morcegos e outros animais que bebem dessas lagoas com cianeto foram envenenados.
Há registros de uma barragem da Romênia que mantiveram um lago de resíduos isolados e foram danificados por um evento climático.
Como conseqüência, toneladas de cianeto foram liberadas para o rio Sasar e os sistemas de aqüíferos próximos, como o Lapus, Somes, Tisza Rivers, terminando no Danúbio.
Isso causou uma cascata de mortes de animais, ou em outras palavras, um desastre ecológico.
 Extração de ouro com cianeto na Nova Zelândia por volta de 1918. Você pode ver a quantidade de água contaminada, que foi descarregada nos rios próximos. Biblioteca Nacional NZ On The Commons [Sem restrições]. Fonte: Wikimedia Commons.
Extração de ouro com cianeto na Nova Zelândia por volta de 1918. Você pode ver a quantidade de água contaminada, que foi descarregada nos rios próximos. Biblioteca Nacional NZ On The Commons [Sem restrições]. Fonte: Wikimedia Commons. Na produção de outros compostos químicos
O NACN de cianeto de sódio é usado na síntese de vários tipos de compostos orgânicos.
Pode servir a você: óxido de sódio (Na2O): estrutura, fórmula, propriedades, riscosPor exemplo, pigmentos e corantes são preparados (incluindo esmaltes ópticos), compostos para uso em agricultura ou agroquímicos e vários produtos farmacêuticos.
Também serve para obter agentes quelatórios ou sequestros de íons metálicos.
Com o cianeto de sódio, os compostos chamados nitriles são preparados, que quando tratados com ácido ácido ou solução aquosa alcalina permite obter ácidos carboxílicos.
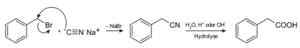 Preparação de um ácido carboxílico usando cianeto de sódio NACN. Roland Mattern [domínio público]. Fonte: Wikimedia Commons.
Preparação de um ácido carboxílico usando cianeto de sódio NACN. Roland Mattern [domínio público]. Fonte: Wikimedia Commons. Permite preparar ácidos graxos com grupos ciano, cianetos de metais pesados e cianeto de hidrogênio HCN.
Na indústria de metal
O NACN é usado nas soluções usadas em galvanoplastia ou eletrodo de metal (revestimento de metal com outras pessoas), por exemplo, zinco.
É um componente de aço endurecido. Também serve na limpeza de metais.
Em outros usos
O cianeto de sódio é um intermediário na fabricação de nylon.
É usado para separar minerais por flutuação com espuma.
Aplicações fora de uso, questionadas ou muito raras
A nação foi usada para eliminar roedores, como coelhos e ratos e suas tocas, e para encerrar os cupins ninhos.
Atualmente, é usado ocasionalmente para eliminar coiotes, raposas e cães selvagens. É usado na forma de cápsulas como doses simples ou múltiplas em pastagens, caça e florestas.
Devido à sua extrema toxicidade, o NACN deve ser usado apenas por pessoas preparadas.
Esse uso é considerado muito perigoso para o ser humano, mas há quem ainda o usa.
 A vida selvagem não deve ser eliminada, pois esses animais já lutam para sobreviver em condições difíceis. Autor: Maxwdhs. Fonte: Pixabay.
A vida selvagem não deve ser eliminada, pois esses animais já lutam para sobreviver em condições difíceis. Autor: Maxwdhs. Fonte: Pixabay. Na agricultura, foi usado anteriormente para fumigar árvores frutíferas cítricas e outras frutas. Também foi usado como inseticida e miticida (eliminador de ácaros) a serem aplicados após a colheita, para citros não -odiados ou para a fumigação de caminhões usados para transportá -los. Também foi usado para fumigar navios, vagões e armazéns.
Todos esses usos foram questionados pela alta toxicidade do cianeto de sódio. Por esse motivo, não é mais usado ou apenas muito raramente e sob condições muito controladas.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Cianeto de sódio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Quarta edição. John Wiley & Sons.
- Hurst, h.E. e Martin, M.D. (2017). Toxicologia. Cianeto. Em farmacologia e terapêutica para odontologia (sétima edição). Recuperado de cientedirect.com.
- Coppock, r.C. e Dziwenka, M. (2015). Ameaças à vida selvagem por agentes de guerra química. No Manual de Toxicologia de Agentes de Guerra Química (segunda edição). Recuperado de cientedirect.com.
- Morrison, r.T. e boyd, r.N. (2002). Química orgânica. 6ª edição. Prentice-Hall.
- « Estrutura de trioxido de enxofre (SO3), propriedades, riscos, usos
- Estrutura de óxido de bário (BAO), propriedades, usos, riscos »

