Átomo neutro
- 1237
- 89
- Dennis Heidenreich
O que é um átomo neutro?
A átomo neutro É aquele que não possui carga elétrica devido à compensação entre o número de seus prótons e elétrons. Ambos são partículas subatômicas carregadas eletricamente.
Os prótons são aglomerados ao lado dos nêutrons e compõem o núcleo; Enquanto os elétrons estão embaçados ao definir uma nuvem eletrônica. Quando o número de prótons em um átomo, igual ao seu número atômico (Z), é igual ao número de elétrons, diz -se que há compensação entre cargas elétricas dentro do átomo.
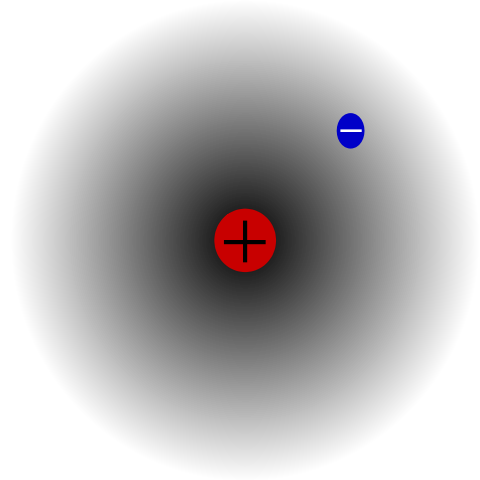
 Átomo de hidrogênio. Fonte: Mets501 via Wikipedia.
Átomo de hidrogênio. Fonte: Mets501 via Wikipedia. Há, por exemplo, um átomo de hidrogênio (imagem superior), que possui um próton e um elétron. O próton está posicionado no centro do átomo como núcleo, enquanto o elétron orbita o espaço circundante, deixando regiões de menos densidade eletrônica à medida que se afasta do núcleo.
Este é um átomo neutro, porque é verdade que z é igual ao número de elétrons (1p = 1e). Se o átomo de H perdesse esse único próton, o raio atômico foi encolhido e prevaleceria a carga do próton, tornando -se o hi -cation+ (Hydron). Se, por outro lado, vencesse um elétron, haveria dois elétrons e se tornaria ânion h-- (Hidreto).
Átomo de íons neutro vs
Para o exemplo do átomo neutro de H, foi visto que é cumprido que o número de prótons é igual ao número de elétrons (1p = 1e); situação que não acontece com os íons derivados de A perda ou ganho de um elétron.
Os íons são formados por uma mudança no número de elétrons, porque o Atom Win (-) ou os perde (+).
Pode atendê -lo: fase dispersaNo átomo do cátion h+ A valência do próton solitário predomina em face da ausência total de um elétron (1p> 0e). Isso é verdade para todos os outros átomos mais pesados (np> ne) da tabela periódica.
Embora a presença de uma carga positiva possa parecer insignificante, ela altera na diagonal as características do elemento em questão.
Por outro lado, no ânion átomo h- A carga negativa dos dois elétrons predomina na frente do único próton do núcleo (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs Na+
Um exemplo mais conhecido é o de sódio metálico. Seu átomo neutro, Na, com z = 11, tem 11 prótons; Portanto, deve haver 11 elétrons para compensar cargas positivas (11p = 11e).
O sódio por ser um elemento metálico altamente eletropositivo perde seus elétrons com muita facilidade; Nesse caso, perde apenas um, o de sua camada de Valência (11p> 10e). Assim, o cátion é formado+, que interage eletroestaticamente com um ânion; Como cloreto, CL-, No sal de cloreto de sal, NaCl.
O sódio metálico é venenoso e corrosivo, enquanto seu cátion está presente dentro das células. Isso demonstra como as propriedades de um elemento podem variar drasticamente quando vencer ou perder elétrons.
Por outro lado, o nion na- (Soduro, hipoteticamente) não existe; E para poder se formar, seria extremamente reativo, pois vai contra a natureza química do sódio para ganhar elétrons. Então uma- Teria 12 elétrons, superando a carga positiva de seu núcleo (11p<12e).
Pode atendê -lo: oxigênio molecular: estrutura, propriedades, usosMoléculas neutras
Os átomos estão ligados covalentemente para dar origem a moléculas, que composto também pode ser chamado. Dentro de uma molécula, não pode haver íons isolados; Em vez disso, existem átomos com cargas formais positivas ou negativas. Esses átomos carregados afetam a carga líquida da molécula, transformando -a em um íon policímico.
Para que uma molécula seja neutra, a soma das cargas formais de seus átomos deve ser igual a zero; Ou, mais simplesmente, todos os seus átomos são neutros. Se os átomos que compõem uma molécula forem neutros, isso também será.
Por exemplo, você tem a molécula de água, h2QUALQUER. Seus dois átomos de H são neutros, assim como o átomo de oxigênio. Eles não podem ser representados da mesma maneira, como mostrado na imagem do átomo de hidrogênio; Como, embora o núcleo não mude, a nuvem eletrônica.
O hidronio ion, h3QUALQUER+, Por outro lado, ele tem um átomo de oxigênio com carga parcial positiva. Isso significa que, nesse íon poliiatômico, perde um elétron e, portanto, seu número de prótons é maior que o de seus elétrons.
Exemplos de átomos neutros
Oxigênio
O átomo de oxigênio neutro tem 8 prótons e 8 elétrons. Quando ele ganha dois elétrons, forma o que é conhecido como ânion de óxido, ou2-. Nele, cargas negativas predominam, tendo um excesso de dois elétrons (8p<10e).
Os átomos de oxigênio neutro têm uma alta tendência a reagir e se juntar a si mesmos para formar ou2. É por esse motivo que não há átomos ou "soltos" lá no seu destino e sem reagir com nada. Todas as reações conhecidas para este gás são concedidas ao oxigênio molecular, ou2.
Pode servir a você: metais alcalinotherrososCobre
O cobre possui 29 prótons e 29 elétrons (além de nêutrons). Ao contrário do oxigênio, seus átomos neutros podem ser encontrados na natureza devido à sua ligação metálica e estabilidade relativa.
Como sódio, tende a perder elétrons em vez de conquistá -los. Dada sua configuração eletrônica e outros aspectos, você pode perder um ou dois elétrons, tornando -se CUPROS+, Ó Cuprico, Cu2+, respectivamente.
A CUCION CU+ Tem um menos elétron (29p<28e), y el Cu2+ perdeu dois elétrons (29p<27e).
gases nobres
Os gases nobres (ele, ne, ar, kr, xe, rn), são um dos poucos elementos que existem na forma de seus átomos neutros. Seus números atômicos são: 2, 10, 18, 36, 54 e 86, respectivamente. Eles não ganham ou perdem elétrons; Embora o Xenon, XE, possa formar compostos com fluorina e perder elétrons.
Ligas de metais
Os metais estão protegidos da corrosão podem manter seus átomos neutros, unidos por links de metal. Em ligas, soluções de metal sólido, os átomos permanecem (principalmente) neutros. Em latão, por exemplo, existem átomos neutros de Cu e Zn.
Referências
- O que é um átomo neutro? Recuperado de: Introdução à Física.com
- Exemplo de átomos não neutros. Cienting. Recuperado de: cienting.com

