Coloração de Wright
- 1589
- 306
- Lonnie MacGyver
 Vários Smess de Blood Periférico tingidos com manchas de Wright. PARA. Leucemia aguda b. Plasmodium vivax dentro do eritrócito. C. Plasmodium falciparum, macrogametocito. D. Linfócitos
Vários Smess de Blood Periférico tingidos com manchas de Wright. PARA. Leucemia aguda b. Plasmodium vivax dentro do eritrócito. C. Plasmodium falciparum, macrogametocito. D. Linfócitos O que é a coloração de Wright?
O Coloração de Wright É uma técnica de coloração criada pelo patologista americano James Homer Wright em 1902, baseado na coloração de Romanowsky, para melhor diferenciar diferentes tipos de células sanguíneas.
Esta coloração é policromática, o que significa que gera várias cores, dependendo da estrutura que absorve o corante. Esta técnica de coloração tem sido amplamente usada para realizar glóbulos brancos diferenciais e estudar a morfologia de glóbulos vermelhos, plaquetas e leucócitos no sangue periférico e na medula óssea.
Sua aplicação é muito importante, pois as anormalidades podem ser vistas nas diferentes linhas celulares do sangue, facilitando o diagnóstico de doenças como leucemia ou infecções bacterianas ou parasitárias.
Talvez essas sejam as aplicações mais comuns nas quais essa técnica é usada, no entanto, elas não são as únicas. Também é útil em outras amostras que não o sangue e a medula óssea, como amostras de secreção nasal, muco fecal, escarro, pele, entre outros.
Fundação da coloração de Wright
A coloração de Wright nasceu da mancha de Romanowsky.
A mistura de corantes usados na coloração de Wright causa o efeito conhecido como Romanowsky, ou seja, fornece uma bela coloração roxa para os núcleos de leucócitos e grânulos neutrofílicos, enquanto os glóbulos vermelhos são tingidos.
Os componentes responsáveis por fornecer a gama de cores típicas da coloração de Wright são azuis B e Eosina e. O efeito observado dependerá da ligação dos corantes às estruturas químicas e das interações do azul B e da eosina e.
Estruturas ácidas, como ácidos nucleicos, proteínas nucleares e citoplasma reativo imaturo de alguns tipos de células, defina azul b (coloração básica).
Enquanto estruturas básicas, como a hemoglobina, os grânulos dos eosinófilos segmentados, entre outras estruturas celulares, definem a eosina e (coloração ácida).
O resultado da coloração pode ser influenciado por diferentes fatores, como o pH do corante Wright, a solução de amortecimento e lavagem, bem como a coloração e o tempo de fixação.
Portanto, cada etapa na preparação dos reagentes é crucial e deve ser feita cuidando de todos os detalhes.
Materiais
Wright Dye. Para 100 ml, é necessário:
Pese 0.3 gr de Wright Dye, Medida 97 ml de metanol e 3 ml de glicerol.
Preparação
Em uma argamassa, a pesada quantidade do corante de Wright e incorpore gradualmente o glicerol até que a poeira seja totalmente dissolvida.
Posteriormente, o metanol é adicionado, misturado e derramado em uma garrafa de âmbar.
Antes de usar, a solução com movimentos suaves e filtro deve ser agitada.
Pode atendê -lo: Seleção direcional: o que é, definição, exemplosSolução de buffer tamponada
Em um litro de água destilada, 3,76 g de hidrofosfato de dissódio é adicionado (Na2HPO4 2h20) mais 2,1 gr de fosfato de potássio di -hidrogênico (KH2Po4).
Misture muito bem até dissolver todos os reagentes incorporados. Ajuste o pH para 7.2. Despeje em uma jarra de vidro e mantenha à temperatura ambiente.
Materiais adicionais necessários para realizar a coloração
Além disso, outros materiais são necessários para realizar a técnica de coloração, são: porta objetos ou cobre objetos, ponte de coloração, fitas com água ou tampão para lavar, um cronômetro para levar horários de cores e algum material de secagem (papel absorvente, gaze ou algodão ).
Componentes de coloração de Wright
Metanol
O álcool (metanol) serve como um fixador de mancha de sangue para o slide.
Basicamente, é um reativo redutor, desidratador e fixador coagulante. Portanto, sua função é coagular proteínas e torná -las insolúveis, mas sem ser desnaturado.
O metanol é o reagente mais usado para consertar o mancha em todos os laboratórios, pois fornece melhores resultados do que os obtidos com etanol. A concentração ideal é de 99%.
O amortecedor de choque
O amortecedor (solução tamponada) tem a função de ajustar ou manter.
A passagem de fixação com metanol desidratam as células e o amortecedor ajuda a reidratá -las.
Eosina (y)
Eosina tem uma afinidade por componentes básicos porque é um corante ácido. Dois tipos de eosina são conhecidos muito semelhantes um ao outro, tanto que podem ser usados, obtendo o mesmo resultado.
Um é chamado de eosina e eosina amarela ou tetrabromofluoresceína, e o outro, eosina B, eritrosina azulada ou dibromoditrofluoresceína. No entanto, eosin e é o que é usado com mais frequência.
A propriedade mais importante deste corante é sua polaridade negativa, isso o torna atraído por estruturas celulares com carga positiva.
Azul de metileno
É o corante básico. Sua propriedade principal é a metacromia, ou seja, nem todas as estruturas serão tingidas da mesma cor, dependerá da composição química das estruturas que estão colorindo.
Alguns se tornarão claro ou azul escuro, e outros de roxo escuro ou lilás pálido.
Técnica
- Faça a amostra estendida para que haja um filme fino, seja em um slide ou capas.
- Deixe o ar secar por aproximadamente 2 horas.
- Coloque o cheiro seco na ponte da coloração ou em manchas com a amostra estendida.
- Cubra a folha com a queda de Wright por GoTa para cobrir toda a superfície. ACTA DE IMPORTA por 5-8 minutos.
- O corante deve cobrir completamente o slide, sem derramar pelas bordas. Se durante o tempo de coloração começar a evaporar, gotas adicionais devem ser colocadas.
- Posteriormente, adicione uma quantidade igual do amortecedor, sopra um pouco até que o brilho metálico característico apareça. Tame 10 a 15 minutos.
- Lave com água da torneira, colocando o jato macio até que a folha pareça rosa.
- Com uma gaze impregnada com álcool eliminou a coloração para colorir na parte traseira do slide.
- Deixe a mancha secar antes de colocar o óleo de imersão para visualizá -lo no microscópio.
Usos/aplicações de coloração Wright
Hematologia
É ideal para a coloração de lixo do sangue periférico.
Devido às propriedades químicas dessa combinação de corantes, as estruturas celulares podem ser facilmente reconhecidas, sendo capaz de distinguir os diferentes tipos de células presentes.
Secreção nasal
Esta técnica é muito útil para identificar células de secreção nasal (células epiteliais, eosinófilos segmentados, polimorfonuclear) no diagnóstico de rinite alérgica.
parasitologia
Nesse sentido, tem sido útil para o estudo de Leishmania sp Dentro dos histiócitos do tecido celular subcutâneo em úlceras de pele. Também é usado para identificar leucócitos na amostra de fezes (leucograma fecal).
Nesse caso, é interessante para o médico saber se a leucocitose presente nas fezes é por polimorfonuclear ou mononuclear. Essa descoberta no leucograma fecal orientará se é uma infecção bacteriana ou viral, respectivamente.
Por outro lado, os parasitas que circulam no sangue podem estar dentro do eritrócito ou livre no plasma. Os parasitas procurados são Plasmodium spp, Trypanosoma cruzii e filarias, e na veterinário é útil na busca Theilery Equ e Babesia Caballi, Agentes causais do bebê, especialmente em cavalos.
A coloração de Wright, e também a de Giemsa, permite diferenciar hemoparasitas dos componentes celulares normais. Para isso, dois tipos de estendidos podem ser usados:
Bem estendido
O sangue é estendido como um filme fino em um slide. Coloração de Wright, revelando as características do núcleo e citoplasma.
Gota grossa
Esta metodologia é usada para investigar a presença de parasitas em uma quantidade maior de sangue.
Para isso, uma grande gota de sangue é colocada em um slide. Uma vez lá, você deve desfibrar, fazendo círculos cada vez maiores do centro, usando a borda de outro slide.
Finalmente, para observar os parasitas no cheiro grosso, os eritrócitos devem ser listados com água.
Infecções respiratórias
No nível respiratório, essa técnica também é útil, porque as células presentes nas amostras de escarro, a lavagem brônquica ou broqualveolar são importantes para estabelecer o diagnóstico.
Aqui você pode distinguir células polimorfonucleares e células mononucleares.
Bacteriologia
O uso dessa técnica em bacteriologia é limitado, porque não é bom tingir bactérias. Portanto, para a coloração, outras técnicas de coloração especializadas são usadas.
No entanto, tem sido usado para pesquisar células epiteliais com corpos de inclusão Chlamydia trachomatis Em mancha de mucosa uretral ou endocervical, embora deva ser reconhecido que não é o melhor método.
Pode atendê -lo: hemocianinasTambém é possível observar, entre glóbulos vermelhos, bactérias espirais, como Borrelia Burgdorferi Em pacientes infectados, bem como morulas ou corpos de inclusão de Ehrlichia sp No citoplasma de linfócitos, monócitos ou neutrófilos em um mancha de sangue.
Micologia
Ele Histoplasma capsulatum É um fungo patogênico frequentemente diagnosticado pela observação microscópica de várias amostras de tecido, tingindo com coloração com Wright.
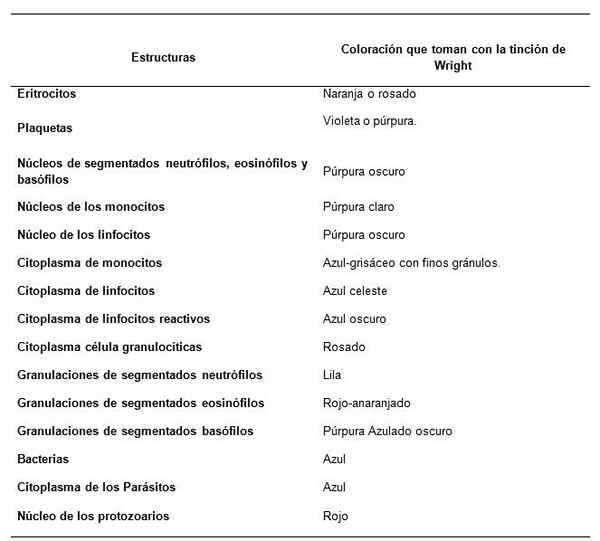
Como as estruturas da amostra de sangue são observadas com a coloração de Wright?
 Recomendações para o Tincion of Sanguineous Srols para leitura de hemograma. Fonte: Retamales E, Mazo V. Instituto de Saúde Pública, Governo do Chile
Recomendações para o Tincion of Sanguineous Srols para leitura de hemograma. Fonte: Retamales E, Mazo V. Instituto de Saúde Pública, Governo do Chile Recomendações para uma boa coloração
- As extensões de amostras de sangue devem secar espontaneamente. Os manchas devem ser o mais finos possível para obter uma melhor fixação do corante e evitar sobrepostos.
- Para tingimento de alta qualidade, é aconselhável. Por outro lado, a amostra ideal é o sangue capilar, sem anticoagulante.
- No entanto, se o sangue venoso for usado, ele deve ser usado como um anticoagulante de EDTA e não -heparina, pois este pode deformar estruturas celulares.
- Para evitar a deterioração do corante preparado, ele deve ser armazenado em lugares secos.
- Durante o processo de lavagem, o uso de água ajustado ao pH neutro é recomendado.
- É aconselhável testar os métodos de tingimento usados em laboratório de tempos em tempos.
Isso é feito para manchas amostras ou padrões estendidos, como controle de qualidade. Esta etapa é importante, uma vez que é garantido que a mancha esteja adequadamente preparada e os tempos de coloração sejam bem padronizados.
Se a folha de padrões for muito colorida, há problemas que devem ser resolvidos.
Erros comuns na coloração de Wright
Coloração muito pálida
Os manchas muito pálidas geralmente são devido a um tempo muito curto de manchas ou a uma lavagem muito exagerada. É corrigido prolongando o tempo de contato com o corante ou diminuindo o tempo de lavagem.
Sinos do corante
A presença de precipita a coloração no cheiro pode ter várias causas. Os mais frequentes são: uso do corante não filtrado, corante em pontes irregulares de coloração, use lençóis sujos com poeira ou gordura, não lavando bem quando a mancha é concluída.
Esfregando com coloração extremamente avermelhada ou azul
O amortecedor é responsável pelo pH do corante. Cores com pH abaixo do indicado (ácido) resultarão na obtenção de cheiros muito avermelhados.
Se o pH do corante estiver acima (alcalina) obterá um mancha extremamente azul.
Modo de armazenamento
O reagente deve ser armazenado à temperatura ambiente.
Referências
- López-Jácome, l., Hernández-Durán, m., Colín-Castro, c., Ortega-Peña, s., Cerón-González, g., Franco-centejas, f. (2014). Coloração básica no laboratório de microbiologia. Pesquisa por invalidez.
- Calderón, a., Cardona, J., Vergara, ou. (2013). Frequência Babesia spp. Em cavalos de Montería, Córdoba (Colômbia). Rev. UDCAACTUAL DESCUGULADO. cientista.
- Retamales, e., Mazo, v. Instituto de Saúde Pública do Chile. Recomendações para o Tincion of Sanguineous Srols para leitura de hemograma.

