Coloração de grama
- 4100
- 1171
- Ralph Kohler
 A coloração de grama é útil para visualizar diferentes tipos de bactérias
A coloração de grama é útil para visualizar diferentes tipos de bactérias O que é coloração de Gram?
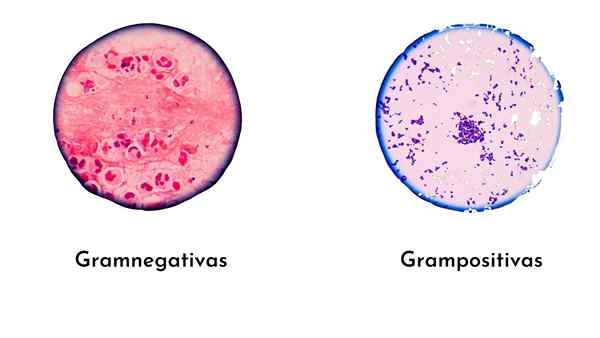
O Coloração de grama É a técnica de coloração mais simples e útil da microbiologia diagnóstica para identificar bactérias. Esta técnica foi criada pelo Doutor Christian Gram em 1884, que classificou bactérias em gramas -positivas (roxas) e Gram -negativo (rosa), de acordo com a composição da parede celular.
A técnica sofreu certas modificações de Hucker em 1921 para estabilizar os reagentes e melhorar a qualidade da mancha, de modo que a coloração de Gram também é conhecida como Gram-Hucker.
Com esta técnica também é possível. Bem como sua distribuição no espaço: em cluster, em cadeia, isolada, em pares, em tetrads, etc.
Base
É uma técnica que apresenta 4 etapas fundamentais: manchando, fixando com a mordente, descoloração e contratação. Portanto, além de colorir bactérias, também permite diferenciá -las.
Violet Crystal é o primeiro corante usado. O mesmo tem uma afinidade pelo peptidoglicano e tingirá todas as bactérias presentes, posteriormente colocou o Lugol, que atua como um mordente, ou seja, induzirá a formação de complexos insolúveis de vidro violeta/iodo/proteínas ribonucleares dentro da célula.
Bactérias gram -positivas, com uma parede de peptidoglicano espesso, formam mais complexos (vidro violeta/iodo), portanto, eles serão tingidos.
Ele também influencia que a parede de bactérias gram -positivas contém mais ácidos não atendidos, que mostram grande afinidade por agentes oxidantes (Lugol).
Bactérias Gram -negativas têm uma fina Capa de Peptidoglicano, o que torna as bactérias menos complexas que o Gram -positivo.
Posteriormente, vem o passo da descoloração, onde as bactérias gram -positivas e gram -negativas se comportam de maneira diferente.
Bactérias Gram -negativas contêm uma membrana externa rica em lipopolissacarídeos que faz parte de sua parede celular. As gorduras são destruídas pelo contato com o álcool acetona, para que a membrana externa seja desestabilizada, o vidro violeta sendo liberado.
É assim que é mais tarde contratado com a safranina básica ou fuchsin, pegando a cor vermelha.
No caso de bactérias gram -positivas, eles resistem à descoloração porque o alvejante age fechando os poros, o que impede que o complexo de cristal violeta/iodo seja capaz de sair.
Portanto, a coloração com o vidro violeta é estável, e não há lugar para safranina ou fuchsin. Portanto, essas bactérias são tingidas intensas ou roxas.
Materiais
O conjunto de coloração de Gram é composto de:
- Vidro violeta.
- Lugol.
- Álcool de acetona.
- Safranina básica ou fuchsin.
Preparação de corantes e reagentes
Solução de cristal violeta
Solução para:
Violet Crystal - 2 gr
95% - 20 cc álcool etílico
Solução B:
Oxalato de amônio - 0.8 gr
Água destilada- 80 cc
Para a preparação final do vidro violeta, a solução a 1:10 deve ser diluída com água destilada e misturar com 4 partes da solução B. A mistura é armazenada por 24 horas antes de usá -la. É filtrado em uma garrafa de manchas âmbar usando um filtro de papel.
Pode servir a você: Chiapas Flora e Fauna: Espécies RepresentativasA quantidade usada diariamente é movida para uma garrafa de âmbar com conta -gotas.
Iodo-lugol
Pese e meça a quantidade indicada de cada composto, como segue:
Cristais de iodo - 1 gr
Potássio ioduro - 2 gr
Água destilada - 300 cc
O iodeto de potássio é dissolvido pouco a pouco na água e, posteriormente, o iodo é adicionado. A solução para uma garrafa de âmbar é transferida.
A quantidade usada diariamente é movida para uma garrafa menor de âmbar com conta -gotas.
Desconsores
95% de álcool etílico - 50 ml
Acetona - 50 ml
É preparado em partes iguais. Cubra bem, porque tende a evaporar.
Bottero em fut.
Esta preparação fornece uma descoloração de tempo moderada 5-10 seg., E é o mais recomendado.
Os iniciantes preferem usar apenas 95%de álcool etílico, onde a descoloração é mais lenta, de 10 a 30 segundos.
Embora os mais experientes possam usar acetona pura, onde a descoloração ocorre muito rapidamente de 1 a 5 segundos.
Contraste
Solução da mãe safranina
Safranine - 2.5 gr
95%de álcool etílico - 100 cc
Depois de pesar a quantidade indicada de safranina, ele se dissolve a 100 cc de álcool etílico a 95%.
Da solução mãe, a solução de safranina de trabalho é preparada.
Para fazer isso, meça 10 cc da solução mãe, adicione 90 cc de água destilada para completar 100 ml.
Recomenda -se transferir a quantidade usada diariamente para uma garrafa de âmbar com gotejamento.
Microorganismos que são tingidos fracamente com a coloração de Gram-Hucker, como certos anaeróbios, Legionella SP, Campylobacter SP e Brucella sp, Eles podem ser manchados muito melhor se a modificação feita por Kopeloff para a mancha de Gram-Hucker, chamada de coloração Gram-Kopeloff feita.
Esta técnica altera o corante safranina para fuchsin básico. Com esta modificação, é possível colorir efetivamente os microorganismos acima mencionados.
Armazenamento de reagentes
Os corantes preparados devem ser armazenados à temperatura ambiente.
Preparação da amostra estendida para colorir
Uma amostra deve conter pelo menos 105 microorganismos antes de sua observação é provável em uma mancha. Os estendidos podem ser realizados a partir da amostra direta ou culturas em meios sólidos ou líquidos.
Os estendidos devem ser uniformes, bem distribuídos e não muito grossos, para uma melhor visualização das estruturas presentes.
Grama de amostras diretas
Grama de urina sem centrifugando
A urina é mista e 10 µl é colocada em um slide. A observação de pelo menos um campo de bactéria/imersão indica que há infecção.
Isso significa que a colheita terá aproximadamente mais de 100.000 UFC/ml (105 UFC/ml) de urina em 85% dos casos.
Este método não é útil para contagens coloniais abaixo de 100.000 UFC.
Grama do LCF
O LCR deve ser centrífugo, o sobrenadante é removido e o sedimento se estende em um slide. Este líquido é estéril em condições normais. A observação de bactérias indica infecção.
Pode atendê -lo: glândulas salgadasGrama de amostras respiratórias
O grama de escarro, lavagem brônquica ou broncoveolar, embora possa haver uma variedade de microorganismos, sempre guiará o diagnóstico, além de ser útil o tipo de célula observada.
No caso de Esputo, o estendido com as partes mais purulentas da amostra deve ser preparado.
FECES GRAM
Não é aconselhável fazer grama para esse tipo de amostras, pois não tem valor de diagnóstico.
Grama de culturas
Eles podem ser feitos de duas maneiras, uma de culturas líquidas e outra de colheitas sólidas.
Culturas líquidas
A partir de culturas líquidas, é extremamente simples: sob o isqueiro, vários assados do caldo escuro são tomados e colocados em uma lâmina limpa e seca, dando movimentos circulares do centro para a periferia, para distribuir o material uniformemente.
É permitido espontaneamente ao ar. Uma vez seco, o material é fixado na folha com calor. Para fazer isso, com a ajuda de um grampo, você passa na folha 3 a 4 vezes pela chama do Bunsen mais leve, cuidadoso para não queimar o material.
A folha é deixada esfriar e colocada na ponte coloração.
Culturas sólidas
Para realizar uma coloração de grama prolongada de uma colheita sólida, prossiga da seguinte forma:
Antes de escolher as colônias a serem tomadas, você deve preparar o cordeiro caça -níqueis, colocando aproximadamente duas gotas de solução salina fisiológica estéril.
Se a placa de cultivo original contiver vários tipos de colônias diferentes, uma colônia isolada de cada uma será escolhida para realizar o grama. Cada colônia será levada com a alça de platina para dissolvê -la na solução salina anteriormente colocada no slide.
Os movimentos circulares são dados do centro para a periferia, para distribuir homogeneamente a colônia no slide.
É permitido espontaneamente ao ar. Uma vez seco, a folha é fixa com calor, conforme explicado acima (chamando o slot com o isqueiro), tomando cuidado para não queimar o material.
Este procedimento deve ser realizado com cada tipo diferente de colônia. A ordem do que é observado, por exemplo:
Colonia 1: Colonia Amarela Betahemolítica: Cocos -Positivos Gram -Positivos foram observados em aglomerados.
Colonia 2: Cream Colonia, sem hemólise: cocobacilos gramnegativos foram observados.
Cada folha deve ser rotulada para saber o que estamos observando.
Técnica
A técnica de coloração de Gram é extremamente simples de executar e relativamente econômica, e não pode estar faltando em um laboratório de microbiologia.
É feito da seguinte maneira:
- Defina a mancha com calor e coloque na ponte da coloração.
- A folha é completamente coberta com vidro violeta por 1 minuto.
- Lave com água. Não seque.
- Cubra a folha com solução Lugol, vamos agir por 1 minuto. Lave com água. Não seque.
- Decore 5-10 segundos com agitação suave em álcool acetona. O Coloque a folha verticalmente e cair cair as gotas na superfície até arrastar o penteado do cristal violeta. Não exceda.
- Lave com água. Não seque.
- Coloque a folha na ponte da coloração e cubra em 30 segundos com safranina (hucker de grama) ou 1 min com fuchsina básica (grama-kopeloff).
- Lave com água.
- Solte espontaneamente no ar na posição vertical.
Depois de seco, coloque 1 gota de óleo de imersão para observá -lo sob o alvo de 100x no microscópio óptico.
Usos/aplicações de coloração de grama
- Esta técnica permite distinguir as diferenças morfotintoriais da maioria das bactérias.
- Leveduras também se distinguem com esta coloração. Eles pegam o vidro violeta, ou seja, são tingidos grama -positivos.
- Você pode distinguir os esporos Gram -positivos bacilos, onde um espaço claro é observado dentro do Bacillus onde o endospora foi formado, embora os esporos não estejam bem manchados. Para tingir esporos, são usadas outras técnicas, como Shaeffer-Fulton.
- Ajuda a determinar o tipo de antibiótico que deve ser preparado.
Deve -se notar que esta coloração não serve Para colorir todos os tipos de bactérias, ou seja, há casos em que a coloração não funciona.
Nesses casos, as bactérias que não têm parede celular podem ser mencionadas. Por exemplo: gênero Mycoplasma, spheroplast, Ureauplasma, L formas e protoplastos.
Além disso, bactérias com bactérias ricas em ácidos micólicos, como micobactérias e bactérias intracelulares, como clamídias e rickettsias.
Também é ineficaz tingir a maioria das bactérias espíricas.
Existem bactérias do mesmo gênero que podem ser observadas na mesma amostra que Gram -positiva e como Gram -negativa. Quando isso acontece, é chamado de coloração variável de grama, o que pode ser devido à alteração em nutrientes, temperatura, pH ou concentração de eletrólitos.
Erros comuns
Decore exageradamente
Exagerar no passe de descoloração pode causar a observação de microorganismos falsos -negativos.
Não espere por tempo de secagem suficiente para adicionar o óleo de imersão
Este erro faz com que os micels gordos formem que dificultem a observação das estruturas presentes. Isso ocorre quando o óleo se junta às moléculas de água presentes no cheiro.
Invista a ordem dos reagentes
Um erro como esse gerará bactérias Gram -negativas a serem visualizadas, isto é, Falso Gram -Positivo.
Use culturas antigas (sólidos ou líquidos)
Pode causar bactérias gram -positivas para manchar grama -negativo (grama -negativo false). Isso acontece porque nas culturas antigas é provável que haja bactérias mortas ou deterioradas e, sob essas condições, as bactérias não retêm o vidro violeta.
Use uma solução muito antiga Lugol
Com o tempo, a Lugol perde suas propriedades e sua cor está desaparecendo. Se o reagente já degenerado for usado, isso não consertará bem o vidro violeta; portanto, existe a possibilidade de obter uma visualização de microorganismos falsamente -negativos.
Fundo azul
Um fundo adequadamente descolorido será vermelho. Um fundo azul indica que a descoloração era insuficiente.
Referências
- Casas-Rincón, g. (1994). Micologia geral. Universidade Central da Venezuela.
- Coloração de grama. Tirado disso.Wikipedia.org.
- González, m., González, n. (2011). Manual de Microbiologia Médica. Diretoria de Mídia e Publicações da Universidade de Carabobo.

