Coloração de Giemsa
- 2387
- 245
- Ralph Kohler
 A coloração de Giemsa é um método comum para examinar vários tecidos e amostras de sangue
A coloração de Giemsa é um método comum para examinar vários tecidos e amostras de sangue O que é a coloração de Giemsa?
O Coloração de Giemsa É um tipo de amostras clínicas (tecidos, sangue), com base na mistura de ácido e corantes básicos. Criou Gustav Giemsa, químico alemão e bacteriologista, que aperfeiçoou o trabalho de Romanowsky adicionando glicerol para estabilizar os compostos.
As mudanças geradas para a técnica original de Romanowsky permitiram melhorar significativamente as observações microscópicas; portanto, a técnica foi batizada com o nome da coloração com Giemsa.
Sendo uma técnica simples de realizar, de grande funcionalidade e econômica, atualmente é amplamente utilizada no laboratório clínico para cheiro hematológico, amostras de medula óssea e cortes de tecido.
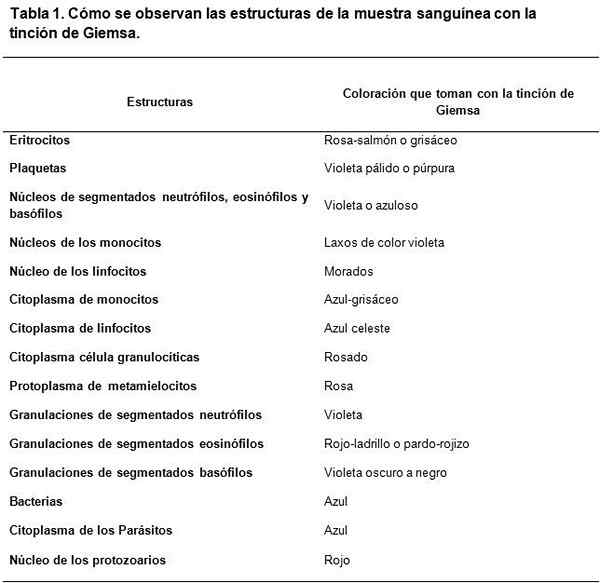
A técnica de coloração da Giemsa é muito útil para estudos citológicos, pois permite a observação de estruturas celulares específicas. Esta técnica mancha citoplasmos, núcleos, nucleolos, vacúolos e grânulos celulares, até distinguindo traços de cromatina fina.
Além disso, mudanças significativas no tamanho, forma ou coloração do núcleo podem ser detectadas, onde é possível.
Fundação da coloração de Giemsa
Os corantes do tipo Romanowsky têm como contraste de base entre ácido e corantes básicos, para matar estruturas básicas e ácidas, respectivamente. Como pode ser visto, há uma afinidade dos corantes ácidos de tingir as estruturas básicas e vice -versa.
O corante básico usado é o azul de metileno e seus derivados enferrujados (Azure A e Azure B), enquanto o corante ácido é eosina.
As estruturas ácidas das células são ácidos nucleicos, os grânulos do segmentado basofílico, entre outros. Portanto, eles serão tingidos com azul de metileno.
Nesse mesmo sentido, as estruturas básicas das células são hemoglobina e alguns grânulos, como o conteúdo nos eosinófilos segmentados, entre outros. Estes serão tingidos com Eosina.
Por outro.
É assim que a combinação estratégica de corantes básicos e ácidos consegue desenvolver um amplo espectro de cores, de acordo com as características bioquímicas de cada estrutura, caminhando por azul claro, azul escuro, lilás e tons azuis roxos, no caso de estruturas ácidas com ácido ácido.
A coloração fornecida por Eosina é mais estável, gerando cores entre avermelhado, laranja e salmão.
Materiais
Preparação da solução mãe
A preparação da solução -mãe requer pesar 600 mg de poeira de Giemsa, medindo 500 cc de álcool metilólico livre de acetona e 50 cc de glicerina neutra.
Modo de preparação
Coloque o pó pesado de Giessa em uma argamassa. Se houver caroços, eles devem ser pulverizados. Posteriormente, adicione uma quantidade apreciável da glicerina medida e misture muito bem. A mistura obtida é derramada em uma garrafa de âmbar muito limpa.
O restante da glicerina é colocado na argamassa. Misture novamente para limpar o restante do corante que ficou preso nas paredes de argamassa e jogue a mesma garrafa.
Pode atendê -lo: conídiaA garrafa é coberta e leva por 2 horas em banho -maria a 55 ° C. Desde que.
Posteriormente, a mistura pode esfriar para colocar o álcool. Anteriormente, uma parte do álcool medida é colocada na argamassa para terminar de lavar o que está colorindo e depois é adicionada à mistura, ao lado do resto do álcool.
Esta preparação deve ser permitida por pelo menos 2 semanas. A parte que é usada na solução mãe deve ser filtrada.
Para evitar a contaminação da preparação, é recomendável passar pela parte que será usada constantemente a uma pequena garrafa de âmbar com gotejamento. Reracharge toda vez que o reagente está esgotado.
Preparação da solução buffer
Por outro lado, uma solução de tampão de 7,2 pH é preparada da seguinte forma:
6,77 gr de fosfato de sódio (anidro) (Nahpo é pesado4), 2,59 gr de fosfato de di -hidrogênio de potássio (KH2Po4) e água destilada até 1.000 cc.
Preparação final para colorir
Para a preparação da solução final de coloração, 2 cc da solução da mãe filtrada são medidos e misturados com 6 cc da solução tampão. A mistura é agitada.
Um fato relevante que deve ser levado em consideração é que as técnicas de preparação para corantes podem mudar de acordo com a casa comercial.
Materiais adicionais necessários para realizar a coloração
Além dos materiais descritos, as pontes de coloração, passam com água ou tampão para lavagem, fatias de deslizamento ou tampa, um cronômetro, um cronômetro para controlar os tempos de coloração e o papel de secagem ou algum material que serve para secar (gaze ou algodão (gaze ou algodão).
Técnica
Processo de coloração
1. Antes da coloração, a amostra estendida em um slide limpo deve estar pronto.
As amostras podem ser sangue, medula óssea, tecidos histológicos ou amostras cervicais-veginais. Recomenda -se que os estendidos estejam bem e tenham 1 ou 2 horas de secagem antes de colori -los.
2. Em uma ponte colorida são colocados todos os lençóis que devem colorir. Sempre funciona na mesma ordem e cada folha é identificada bem.
3. Coloque algumas gotas de 100% (metanol) álcool de metal no cheiro e saia por 3 a 5 minutos, a fim de consertar e desidratar a amostra.
4. Descarte o metanol presente na folha e deixe secar no ar.
5. Depois de secar, coloque a solução de coloração final com um conta -gotas até cobrir toda a folha. ACTA DE DEIXA por 15 minutos. Alguns autores recomendam até 25 min. Depende da casa comercial.
6. Escorra o corante e lave o esfregamento com água destilada ou com uma solução tampão 7.2.
7. Em um papel de secagem, deixe os lençóis ao ar livre secarem, organizados verticalmente com a ajuda de um apoio.
Pode servir a você: Renina: estrutura, produção, secreção, funções8. Limpe a parte de trás do slide com gaze ou algodão umedecido em álcool para eliminar qualquer resto do corante.
Usos/aplicações da coloração de Giemsa
Giemsa's staining technique is used in various areas: in hematology, mycology, bacteriology, parasitology, cytology and cytogenetics.
Hematologia
É o uso mais frequente que é dado a esta coloração. Com ele, cada uma das células presentes em amostras de medula óssea ou sangue periférico é identificado. Além de calcular o número de cada série, ser capaz de detectar leucocitose ou leucopenia, trombocitopenia etc.
Por ser sensível identificar células imaturas, é relevante no diagnóstico de leucemia aguda ou crônica. Também é possível fazer o diagnóstico de anemias, como anemia falciforme drepanocítica, entre outros.
Micologia
Nesta área, seu uso é comum para a busca Histoplasma capsulatum (fungo dimórfico intracelular) em amostras de tecido.
Bacteriologia
Em mancha hematológica tingida com Giemsa, é possível detectar Borrelias sp Em pacientes que estudam a doença chamada recorrente febre. Spiroquetes são observados abundantes entre os eritrócitos, em amostras colhidas no pico febril.
Também é possível visualizar bactérias intracelulares, como Rickettsias sp e Chlamydia trachomatis Em células infectadas.
parasitologia
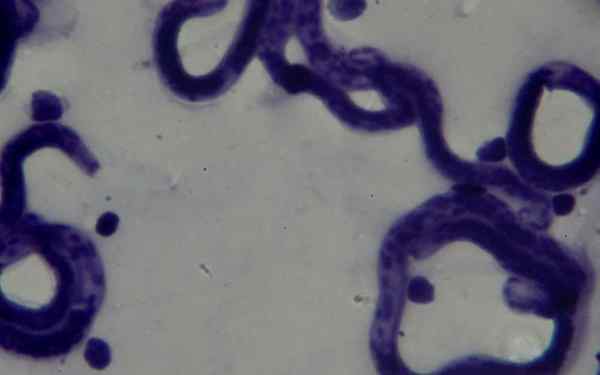
No campo da parasitologia, a coloração de Giemsa permitiu o diagnóstico de doenças parasitárias, como malária, chagas mal e leishmaniose.
Nos dois primeiros, os parasitas Plasmodium sp e ele Cruzi Tripaosoma, respectivamente, eles podem ser visualizados no sangue periférico de pacientes infectados. Eles podem ser encontrados em vários estágios de acordo com a fase em que a doença é.
Para melhorar a busca por parasitas sanguíneos, é recomendado.
Da mesma forma, a leishmaniose cutânea pode ser diagnosticada ao avaliar amostras de biópsias de couro tingidas com giemsa, onde o parasita é encontrado.
Citologia
A coloração de Giemsa também é usada para o estudo citológico de amostras endocervicais, embora não seja a técnica mais frequentemente usada para esse fim.
Mas em casos de escassez de recursos, ele pode ser usado, tendo uma funcionabilidade semelhante à oferecida pelo lago Pap e um custo mais baixo. No entanto, requer experiência pelo exame.
Citogenética
Uma característica relevante da coloração de Giemsa é sua capacidade de se juntar fortemente às regiões ricas em adeninas e timinas do DNA. Isso permite que o DNA seja visualizado durante a miitose celular, em diferentes estados de condensação.
Esses estudos são necessários para detectar aberrações cromáticas, como duplicações, deleções ou translocações das diferentes regiões de cromossomos.
 Coloração de Giemsa. Fonte: PanReac Aplichem ITW Reagentes. Versão 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Espanha.
Coloração de Giemsa. Fonte: PanReac Aplichem ITW Reagentes. Versão 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Espanha. Recomendações para uma boa coloração
- A secagem dos lençóis não deve ser acelerada. O tempo prudencial para a secagem deve ser esperado ao ar livre. Aproximadamente 2 horas.
Pode servir você: Timina- Colorir imediatamente após 2 horas para obter melhores resultados.
- Para que os cheiros sejam consertados e tingidos melhor, a amostra deve ser distribuída na folha para que haja uma camada fina e uniforme.
- A amostra de sangue preferida é o capilar, já que a Smere.
- Se o sangue venoso for usado, o EDTA deve ser usado como anticoagulante e não heparina, pois este último geralmente deforma as células.
Erros comuns na coloração de Giemsa
Na prática desta coloração, você pode cometer erros. Eles são evidenciados por mudanças repentinas nas tonalidades das estruturas.
Coloração extremamente azul
Pode ser devido a:
- Manchas muito grossas.
- Exceder o tempo de coloração.
- Lave insuficientemente.
- Uso de reagentes bem acima do pH neutro (alcalino).
Nessas condições, as cores das seguintes estruturas são distorcidas, de tal maneira que os eritrócitos, em vez de tingir o sal de rosa, N será verde, os grânulos dos eosinófilos que devem ser tingidos em tijolos vermelhos ficarão azulados ou cinzentos ou cinzentos cinza, e assim por diante haverá desvio nos tons habituais.
Coloração excessivamente rosa
Pode ser devido a:
- Tempo de coloração insuficiente.
- Lavagem prolongada ou excessiva.
- Secagem mal.
- Uso de reagentes muito ácidos.
Nesse caso em particular, as estruturas que normalmente são tingidas em azul não serão quase visíveis, enquanto as estruturas tingidas como rosa terão tons muito exagerados.
Exemplo: os eritrócitos levarão uma cor vermelha brilhante ou laranja forte, a cromatina nuclear parecerá rosa pálido e os grânulos eosinofílicos serão tingidos de vermelho brilhante vermelho brilhante brilhante.
Presença de precipitados na mancha
As causas podem ser:
- Use fatias sujas ou ruins.
- Não deixe o mancha secar.
- Deixe a solução de fixação por muito tempo.
- Lavagem inadequada no final da mancha.
- Filtração inadequada ou não -infiltração do corante que está sendo usado.
Presença de artefatos morfológicos
Nos manchas, os artefatos morfológicos podem parecer que dificultam a visualização e interpretação das estruturas presentes. Isto é porque:
- Tipo de anticoagulante usado, como heparina.
- Uso de folhas sujas, deterioradas ou oleosas.
Modo de armazenamento
Depois de preparado, o corante deve ser mantido à temperatura ambiente (15-25 ° C), para impedir que o corante precipite. Deve ser armazenado em um recipiente de âmbar bem fechado.
Referências
- Cannova, d., Brito, e. E Simons, M. (2016). Avaliação de técnicas de coloração para o diagnóstico de leishmaniose cutânea. Salus.
- Reagtos PanReac Applichem ITW. Coloração de Giemsa. Versão 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Espanha.
- Clark, g. Procedimentos de coloração (1981). Williams & Willkins.

