Éter etílico

- 3405
- 305
- Lonnie MacGyver
 O éter etílico é um líquido volátil e inflamável que serviu como anestésico no século XIX
O éter etílico é um líquido volátil e inflamável que serviu como anestésico no século XIX O que é éter etílico?
Ele éter etílico, Também conhecido como Ether Dietyl, é um composto orgânico cuja fórmula química é C4H10QUALQUER. É caracterizado por ser um líquido incolor e volátil e, portanto, suas garrafas devem ser mantidas fechadas o mais forte possível.
Este éter. Isto é, eles têm a fórmula ROR ', onde r e r' representam diferentes segmentos carbonatados. E, como descrito por seu segundo nome, Dietyl Ether, são dois radicais -etil que estão ligados ao átomo de oxigênio.
Inicialmente, o éter etílico foi usado como anestésico geral, introduzido em 1846 por William Thomas Green Morton. No entanto, devido à sua inflamabilidade, seu uso foi descartado, substituindo -o por outros anestésicos menos perigosos.
Este composto também foi usado para calcular o tempo de circulação sanguínea, durante a avaliação do status cardiovascular do paciente.
Estrutura de éter etílico
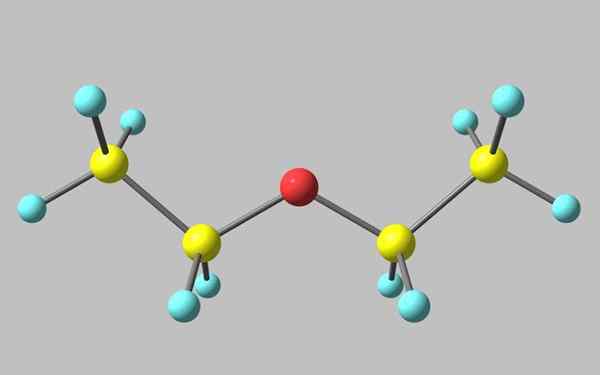 Estrutura química do éter etílico
Estrutura química do éter etílico Na imagem superior, há uma representação com um modelo de esferas e barras da estrutura molecular do éter etílico.
Como pode ser visto, a esfera vermelha, correspondente ao átomo de oxigênio, tem dois grupos etílicos ligados a ambos os lados. Todos os links são simples, flexíveis e de rotação livre ao redor dos eixos σ.
Essas rotações originam os estereoisômeros conhecidos como conformadores, que mais do que isômeros são estados espaciais alternativos. A estrutura da imagem corresponde exatamente ao anti -conforme, no qual todos os seus grupos atômicos são escalonados (separados um do outro).
O outro confroero é eclipsado e, embora não seja a sua imagem disponível, é suficiente visualizá -la com um u -em. Nas extremidades superiores do U, os grupos metil seriam localizados, -Ch3, que experimentariam repulsões estéricas (eles colidiriam no espaço).
Pode atendê -lo: Faraday constantePortanto, pode -se esperar que a molécula de Cho3CH2OCH2CH3 Adote anti -formação na maioria das vezes.
Propriedades físicas e químicas do éter etílico
Outros nomes
- Éter dietílico
- Etoxytano
- Óxido de etila
Fórmula molecular
C4H10O O (C2H5)2QUALQUER.
Peso molecular
74.14 g/mol.
Aspecto físico
Líquido incolor.
Cheiro
Doce e picante.
Sabor
Queima e doce.
Ponto de ebulição
94.3 ° F (34.6 ° C) a 760 mm Hg.
Ponto de fusão
-177.3 ° F (-116.3 ° C). Cristais estáveis.
ponto de ignição
-49 ° F (recipiente fechado).
Solubilidade em água
6.04 g/100 ml a 25 ° C.
Solubilidade em outros líquidos
Miscível com alifático de cadeia curta, benzeno, clorofórmio, éter de óleo, solvente de gordura, muitos óleos e ácido clorídrico concentrado.
Solúvel em acetona e muito solúvel em etanol. Também é solúvel em gasolina, benzeno e óleos.
Densidade
0.714 mg/ml a 68 ° F (20 ° C).
Densidade de vapor
2.55 (em relação ao ar tomado com a densidade 1).
Pressão de vapor
442 mm Hg a 68 ° F. 538 mm Hg a 25 ° C. 58,6 kPa a 20 ° C.
Estabilidade
É lentamente oxidado pela ação do ar, umidade e luz com formação de peróxidos.
A formação de peróxidos pode ocorrer em recipientes de éter que foram abertos e permanecem em armazenamento por mais de seis meses. Peróxidos podem desencadear atrito, impacto ou aquecimento.
Seu contato com: zinco, halogênios, oxihaluros não metálicos, agentes oxidantes fortes, cloreto de cromil, óleos de treiminos, nitratos e cloretos de metal devem ser evitados.
Auto -ignição
356 ° F (180 ° C).
Decomposição
Quando ele se aquece, ele quebra, emitindo um acre e irritante.
Gosma
0.2448 Poise a 20 ° C.
Calor de combustão
8.807 kcal/g.
Pode atendê -lo: Einstenio (s): estrutura, propriedades, obtenção, usosCalor de vaporização
89.8 cal/g a 30 ° C.
Tensão superficial
17.06 Dynas/cm a 20 ° C.
Potencial de ionização
9.53 eV.
Limiar de cheiro
0.83 ppm (pureza não é dada).
Índice de refração
1.355 a 15 ° C.
Obtendo o éter etílico
Éter etílico do álcool etílico pode ser obtido, na presença de ácido sulfúrico como catalisador. Ácido sulfúrico em um meio aquoso se dissocia produzindo o íon hidrônio, h3QUALQUER+.
No processo oposto, ou seja, a hidratação do etileno na fase de vapor, o éter etílico pode se formar como um produto colateral, além de álcool etílico. De fato, esta rota sintética produz a maior parte desse composto orgânico.
Toxicidade de éter etílico
Pode produzir irritações da pele e dos olhos. O contato da pele pode produzir sua ressecção e rachaduras. O éter geralmente não penetra na pele, pois é rapidamente evaporado.
A irritação dos olhos causada pelo éter é geralmente leve e, no caso de irritação grave, o dano é geralmente reversível.
Sua ingestão produz efeitos narcóticos e irritação do estômago. A ingestão severa pode causar danos nos rins.
A inalação de éter pode causar irritação no nariz e na garganta. No caso de uma inalação de éter, pode ser produzido: sonolência, excitação, tontura, vômito, respiração irregular e aumento da salivação.
Alta exposição pode causar perda de conhecimento e até morte.
A OSHA estabelece um limite de exposição trabalhista de 800 ppm em média, durante um turno de 8 horas.
Níveis de irritação ocular: 100 ppm (humanos). Níveis de irritação ocular: 1200 mg/m3 (400 ppm).
Usa/aplicações do éter etílico
Solvente orgânico
É um solvente orgânico usado para dissolver bromo, iodo e outros halogênios. A maioria dos lipídios (gorduras), resinas, borrachas puras, alguns alcalóides, borrachas, perfumes, acetato de celulose, nitrato de celulose, hidrocarbonetos e corantes.
Pode servir a você: sem metais: história, propriedades, grupos, usosAlém disso, é usado na extração dos ingredientes ativos dos tecidos de animais e plantas, porque tem menos densidade do que a água e os carros alegóricos, deixando as substâncias desejadas dissolvidas no éter.
Anestesia geral
Ele tem sido usado como anestésico geral desde 1840, substituindo o clorofórmio por ter uma vantagem terapêutica. No entanto, é uma substância inflamável e, portanto, encontra dificuldades graves em seu uso em áreas clínicas.
Além disso, produz em pacientes alguns efeitos colaterais pós -operatórios indesejáveis, como náusea e vômito.
Por esses motivos, o uso do éter foi descartado como anestésico geral, substituindo -o por outros anestésicos, como Halotano.
Espírito éter
Etanol misto éter.
Avaliação da circulação sanguínea
O éter foi usado para avaliar a circulação sanguínea entre um braço e os pulmões. O éter é injetado em um braço, levando o sangue para o átrio direito, depois para o ventrículo direito e de lá para os pulmões.
O tempo que decorre da injeção do éter, para a captura do cheiro do éter no ar expirado, é de aproximadamente 4 a 6 s.
Laboratórios de ensino
O éter é usado em laboratórios de ensino em muitos experimentos. Por exemplo, na demonstração das leis de genética de Mendel.
O éter é usado para entorpecer as moscas de gênero Drosophila e permitir as cruzes necessárias entre eles, para destacar as leis da genética.
Referências
- Graham Solomons t.C., Craig b. Fryhle. Química orgânica. Aminas. Wiley Plus.
- Éter de ether. Recuperado da Britannica.com

