Bases ácidas Arrhenius, teorias de Bronsted-Lowry, Lewis

- 961
- 112
- Mr. Reginald Lindgren
 Gráfico que relaciona as três principais teorias de ácidos e bases. Fonte: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons
Gráfico que relaciona as três principais teorias de ácidos e bases. Fonte: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons O que são teorias ácidas e base?
As teorias ácidas e base são um conjunto de contribuições conceituais que definem e diferenciam ácidos e bases, dois conglomerados de imensas substâncias relevantes nos campos da química.
Suas raízes vêm das primeiras caracterizações feitas por Robert Boyle em 1661, que definiram ácidos como substâncias azedas e corrosivas que mudam a cor do papel de mola azul para vermelho; E as bases como substâncias com sabão que, diferentemente dos ácidos, mudam a cor do papel vermelho para a canela.
Antoine Lavoisier propôs que todos os ácidos contenham átomos de oxigênio, como H2SW4 e hno3. Séculos depois de 1811, Humphry Davy descobriu que muitos ácidos realmente não possuíam átomos de oxigênio, como HCL, HF, HBR, etc.
E pouco antes do aparecimento da famosa tríade ácida (imagem superior), Justig Liebig sugeriu que os ácidos possuem átomos de hidrogênio que podem ser substituídos por cátions de metal.
Esse conhecimento empírico serviu de inspiração para as teorias atuais de ácidos e bases: Arrhenius, Bronsted-Lowry e Lewis. Como visto no gráfico, a teoria de Arrhenius é a mais restritiva ou limitada de todas, enquanto o de Lewis é o mais geral e globalizado.
Teoria de Arrhenius
Proposta por 1884 por Svante Arrhenius, sua teoria diz que os ácidos quando dissolvidos em água produzem íons h3QUALQUER+ ou h+; Enquanto as bases, ao se dissolver em água, produz ou libere íons OH-.
Os íons h3QUALQUER+ e oh- Eles se combinam em uma reação reversível que gera moléculas de água:
H3QUALQUER+ + Oh- ⇌ 2h2QUALQUER
Pode atendê -lo: ácido dissulfúrico: o que é, estrutura, propriedades, usaPortanto, um ácido arhenius também é aquele que aumenta a concentração de íons h3QUALQUER+, Enquanto uma base de Arrhenius é aquela que aumenta a concentração de íons oh-.
Isso significa que um ácido arhenius não deve necessariamente conter íons h3QUALQUER+, E uma base de Arrhenius não precisa ter íons oh- Em sua estrutura.
Exemplo e limitações
Considere as seguintes dissociações:
HCl (AC) → H+(AC) +CL-(AC)
Naoh (AC) → Na+(AC) +OH-(AC)
HCl é um ácido arhenius porque, quando é dissolvido na água, produz íons h+, ou mais corretamente, íons h3QUALQUER+. E por outro-. Essas substâncias reagem um ao outro para produzir sal e água:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2QUALQUER
O problema com a teoria de Arrhenius reside no fato de ser limitada apenas a soluções aquosas e, portanto, se aplica apenas a substâncias solúveis em água. Por exemplo, o MGO é muito insolúvel na água e, no entanto, é um óxido básico.
Também é incapaz de explicar por si mesmo como substâncias como NH3 e cao produzi ions- dissolvido na água, mesmo quando eles não têm íons oh- Em sua estrutura molecular ou cristalina (como é o caso de NaOH ou KOH).
E ele não explica como o CO2 pode liberar íons h3QUALQUER+ Na água sem ter nenhum átomo de hidrogênio em sua estrutura molecular (como é o caso de HCl ou H2SW4).
Teoria de Brönsted-Lowry
Proposta individualmente em 1923 por Johannes Bronsted e Thomas Lewry, sua teoria de ácidos e bases diz que um ácido é toda essa substância que pode doar íons h+, e que uma base, em vez disso, é qualquer substância capaz de aceitar esses h+. Essa teoria é mais geral que a de Arhenius e abrange várias de suas limitações.
Pode atendê -lo: soluções molares: conceito, preparação, exemplosExemplo
Considere a equação de neutralização entre H novamente3QUALQUER+ e um oh- Para produzir duas moléculas de água:
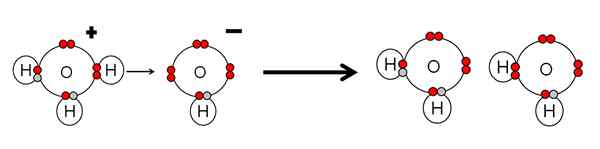 Exemplo de neutralização ácida e base de água. Fonte: Gabriel Bolívar.
Exemplo de neutralização ácida e base de água. Fonte: Gabriel Bolívar. Observe que h3QUALQUER+ Feito um h+ que imediatamente será vinculado ou coordenado com o OH- certo, certo. Quando h+ Termina ligado a um dos pares livres de elétrons do OH-, Duas moléculas de água neutra permanecem como produtos.
O h3QUALQUER+ Portanto, é um ácido Brnsted-Lowry, para doar o H+, e o oh- É uma base de Brnsted-Lowry para aceitar este h+.
Outro exemplo de reação ácido-base é a seguinte:
NH3(G) + HCl (G) → NH4Cl (s)
Essa reação, segundo Arrhenius, não pôde ser considerada do tipo ácido-base porque não ocorre em meio aquoso, mas na fase de vapor ou em um estado gasoso. O NH3 É uma base Brnsted porque aceita o HCl H doando alguns elétrons localizados no átomo de nitrogênio; E o HCl, lógico, torna -se o ácido brnsted.
Assim, o MGO é uma base de Brnsted porque é capaz de aceitar h+ de ácidos para se transformar em mg (oh)2.
Teoria de Lewis
A teoria de Bronsted-Lowry explica um amplo espectro de reações ácidas-base. No entanto, ignore as reações onde os íons h+ e oh- Eles não estão envolvidos, bem como uma maior participação de elétrons livres em mecanismos moleculares.
Assim, em 1923 g. N. Lewis propôs uma teoria da base ácida que diz o seguinte: Um ácido é qualquer substância capaz de aceitar pares de elétrons, enquanto uma base é aquela que doa esses pares de elétrons.
Pode atendê-lo: DAPI (4 ', 6-diamidino-2-fenilindol): características, fundamento, usoPor exemplo, ion h+ É um ácido de Lewis porque aceita pares de elétrons de qualquer espécie ao redor: de H2Ou para originar H3QUALQUER+, de NH3 Para originar NH4+, etc.
Exemplo e vantagens
Considere outro exemplo na seguinte reação:
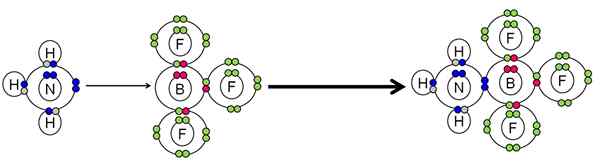 Exemplo de neutralização entre um ácido e uma base de Lewis. Fonte: Gabriel Bolívar.
Exemplo de neutralização entre um ácido e uma base de Lewis. Fonte: Gabriel Bolívar. O NH3 Feito um par de elétrons (azul) do átomo de nitrogênio ao átomo de boro BF3. Portanto, o NH3 É a base de Lewis porque doa o par de elétrons e o BF3 É o ácido de Lewis porque ele os aceita.
Em geral, cátions e espécies de elétrons pobres são ácidos de Lewis, enquanto ânions e espécies ricas em elétrons são bases de Lewis.
As vantagens oferecidas.
Por exemplo: h2O tem elétrons livres em oxigênio. Se você doar um deles para um íon h+, irá atuar como uma base de Lewis, sendo o H+ Consequentemente, ácido de Lewis.
De acordo com Bronsted-Lowry, H2Ou eu estaria agindo como base porque está aceitando com precisão H+ Doando alguns de seus elétrons gratuitos. E finalmente, H2Ou também é uma base de acordo com a teoria de Arrhenius porque a concentração de íons h está diminuindo+ no ambiente aquoso, e consequentemente aumentando a concentração de íons OH-.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Clark Jim. (2002). Teorias de ácidos e bases. Recuperado de: Chemguide.co.Reino Unido
- Broderick c., Moussa m., & Clark J. (21 de agosto de 2020). Visão geral de ácidos e bases. Química Librettexts. Recuperado de: química.Librettexts.org
- Wikipedia. (2020). Reação ácida-base. Recuperado de: em.Wikipedia.org
- Texas A&M University. (s.F.). Ácidos e bases: desenvolvimento de ácidos e bases. Recuperado de: química.Tamu.Edu

