Link da ponte de hidrogênio
- 1075
- 241
- Gilbert Franecki
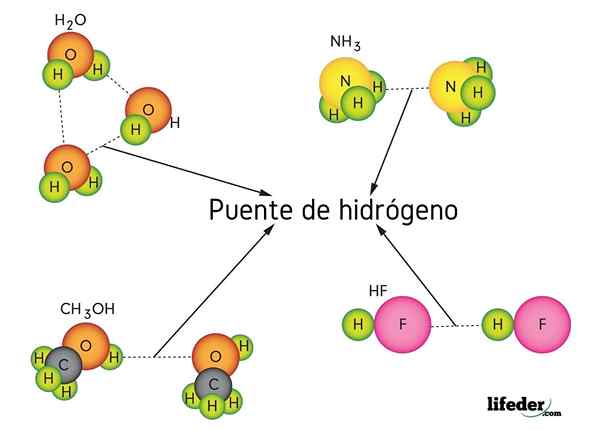
 Ponte de hidrogênio em água (h2O), metanol (CHO3OH), fluoreto de hidrogênio (HF) e amônia (NH3)
Ponte de hidrogênio em água (h2O), metanol (CHO3OH), fluoreto de hidrogênio (HF) e amônia (NH3) O que é um link de ponte de hidrogênio?
A ligação da ponte de hidrogênio é um tipo especial de interação dipolo-dipolo, pertencente às forças de van der Waals, nas quais um átomo de hidrogênio se junta a duas ou mais moléculas sem estar ligado covalentemente. Não se fala de um compartimento de elétrons, mas de um fenômeno principalmente eletrostático.
Como o próprio nome sugere, o hidrogênio atua como uma ponte, então deve estar entre dois átomos. O hidrogênio está ligado (H-X) a um átomo muito eletronegativo (como N, O e F) e se aproxima de outro átomo eletronegativo, mas de uma molécula vizinha. Isso resulta na formação da ponte de hidrogênio x ··· h-x.
Observe que na representação x ··· h-x, os pontos simbolizam a ponte de hidrogênio, enquanto o script representa a ligação covalente entre H e X. Dito isto, vejamos a ponte de hidrogênio entre duas moléculas de água, onde x é o átomo de oxigênio: H2Ou ··· H-OH (imagem inferior).
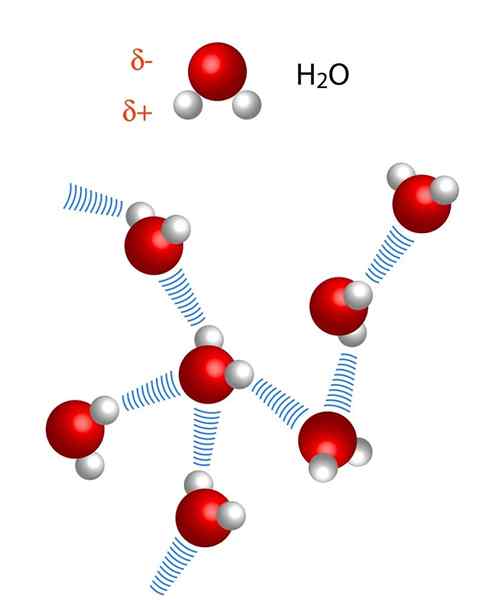
Na imagem acima, vemos que sete moléculas de água permanecem juntas graças às suas pontes de hidrogênio, representadas por linhas azuis. Somente uma ponte de hidrogênio não é muito forte, mas quando há bilhões deles, eles dão ao assunto propriedades anormais e inesperadas.
Características da ponte de hidrogênio
Composição
A ponte de hidrogênio deve ser realmente representada como x '··· h-x, onde x é o que é conhecido como doador de ponte de hidrogênio, porque está covalentemente ligado ao hidrogênio (ele dá).
Enquanto isso, X 'é o aceitador da ponte de hidrogênio, presente em uma molécula vizinha (recebe). Assim, temos um átomo de doador (x), um hidrogênio (h) e um átomo aceitador (x ') compondo a ponte de hidrogênio (x' ··· h-x).
Geométrico
Quando pensamos em uma ponte, superfícies planas ou arqueadas vêm à mente. Como se supõe que os links não se curvam, teremos duas distâncias: x ··· h e h-x, que compõem a ponte de hidrogênio x ··· h-x.
Pode atendê -lo: reação irreversível: características e exemplosEntre essas duas distâncias, há um ângulo, que geralmente é de 180 °; Isto é, os três átomos da nossa ponte repousam na mesma linha horizontal (ou vertical).
Quando o ângulo é diferente de 180º, a ponte x ··· h-x não é mais reta ou linear, mas adquire outras geometrias.
Por outro lado, as distâncias nas pontes de hidrogênio não são idênticas. A distância H-X é menor que x ··· h, que pode ser vista na imagem das moléculas de água. Assim, por exemplo, a distância H-X geralmente é 110 (1,10-12m), enquanto a outra distância x ··· h é 160 pm em diante.
Associativo
Uma característica especial da ponte de hidrogênio é que ela permite que as moléculas sejam muito mais associadas entre si. Eles não andam de um lado para outro ignorando um ao outro. Portanto, estabelece uma ordem momentânea nos seios de líquidos; E no caso de sólidos, eles contribuem para a definição de seus cristais.
Onde vemos uma ponte de hidrogênio, podemos pensar em associação e, portanto, em uma certa ordem (embora dinâmica e em mudança) para escalas moleculares.
Energia
Quebrar uma ponte de hidrogênio não é muito difícil. Moléculas de água, por exemplo, caminhar e criar sempre enquanto mobilizam. Mas quebrar muitos deles ao mesmo tempo implicaria desordenando um número infinito de moléculas. Falamos sobre o fornecimento de uma energia que quebre toupeiras dessas pontes de hidrogênio (6.02 · 1023 X ··· h-x).
Assim, a força da ponte de hidrogênio varia de acordo com as identidades e a natureza das moléculas. Por exemplo, a força da ponte de hidrogênio ou ··· H-O entre água e álcool é 5 kcal/mol: 5 kcal de energia é necessária para quebrar uma toupeira dessa ponte de hidrogênio em questão.
Pode atendê -lo: mudanças químicas: características, exemplos, tiposExemplos de pontes de hidrogênio
Água
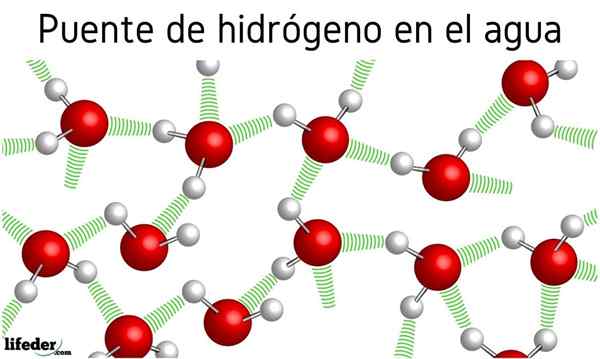
A princípio, houve rumores de pontes de hidrogênio entre as moléculas de água, mas o efeito que isso tem em suas propriedades não foi mencionado. Graças a eles, a água ferve a 100 ° C, deixando os pontos de ebulição de moléculas relacionadas como H2S, que ferve a -60 ºC; ou h2Eu sei, ferva em -41.25 ºC.
Essa diferença abismal é devida a pontes de hidrogênio da água, que também definem outras propriedades anômalas, como seu enorme calor específico, cristais de gelo, sua constante dielétrica, etc.
Etanol
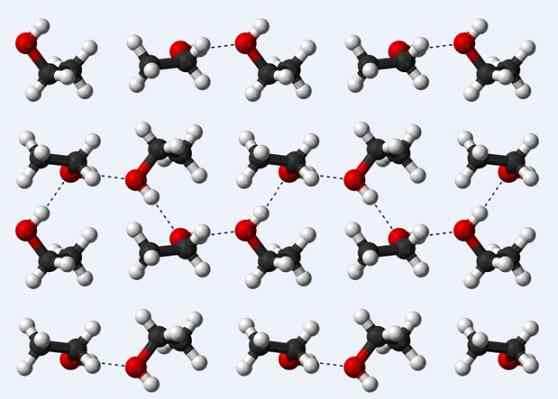 Pontes de hidrogênio em um cristal de etanol
Pontes de hidrogênio em um cristal de etanol Agora vamos ver outra ponte de hidrogênio: a entre moléculas de etanol, CH3CH2Oh (acima). Observe como as moléculas são acomodadas3CH2Oh de tal maneira que suas pontes de hidrogênio são estabelecidas3CH2HOCH HOCH2CH3 (linhas pontilhadas).
No entanto, as moléculas são ordenadas demais para assumir que falamos sobre etanol líquido, mas, em vez disso, compõem um vidro (etanol sólido).
A ponte de hidrogênio descrita para o etanol é semelhante à dos outros álcoois, com a diferença de que seus esqueletos carbonatados podem prejudicar a eficiência das referidas pontes.
Ácido acético
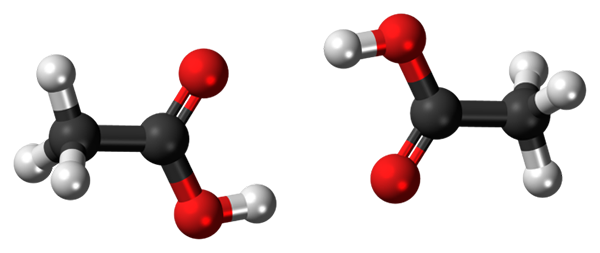 Pontes de hidrogênio entre duas moléculas de ácido acético. Fonte: Jynto, CC0, via Wikimedia Commons
Pontes de hidrogênio entre duas moléculas de ácido acético. Fonte: Jynto, CC0, via Wikimedia Commons Ácido acético, CHO3COOH, é capaz de estabelecer duas pontes de hidrogênio que unem duas moléculas ao mesmo tempo. Por serem duas moléculas ligadas pelas pontes de hidrogênio, falamos sobre um dímero.
Observe que uma dessas pontes de hidrogênio é C = O ··· H-O e a outra O-H ··· O = C. O ácido acético apresenta a peculiaridade que na fase de vapor existe como este dímero.
Pode atendê -lo: ácido mangânico ou permanganicCelulose
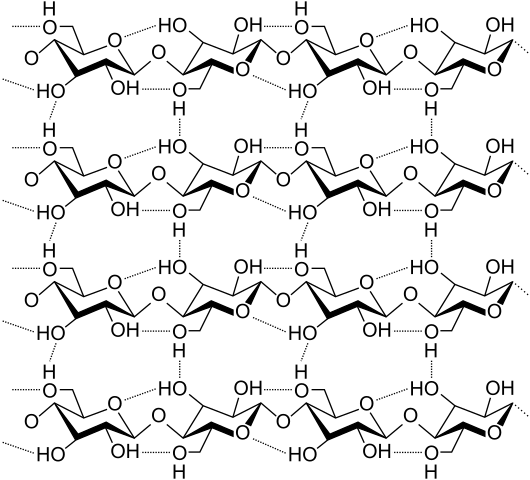 Pontes de hidrogênio entre várias cadeias de celulose. Fonte: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons
Pontes de hidrogênio entre várias cadeias de celulose. Fonte: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons Agora vamos ver mais pontes de hidrogênio diversas e múltiplas. Celulose, um polímero natural, consiste em cadeias compostas por várias unidades de β-glicose.
Cada cadeia permanece fixada a outra graças a muitas pontes de hidrogênio (imagem superior), que reforçam a coesão entre as correntes.
DNA
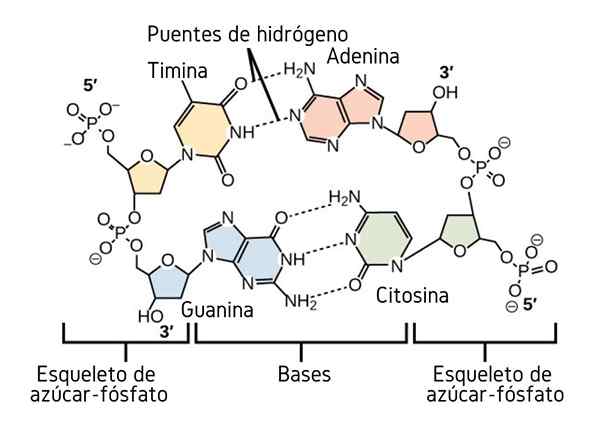 Pontes de hidrogênio entre as bases de nitrogênio do DNA. Fonte: CNX OpenStax, CC por 4.0, via Wikimedia Commons
Pontes de hidrogênio entre as bases de nitrogênio do DNA. Fonte: CNX OpenStax, CC por 4.0, via Wikimedia Commons Até agora, vimos o efeito associativo das pontes de hidrogênio para impor ordem entre as moléculas. Mas que tal uma macromolécula? Em uma macromolécula, como o DNA, encontramos pontes de hidrogênio internas ou intramoleculares entre sua timina, adenina, guanina e citosina (acima) base (acima).
Pontes intramoleculares de hidrogênio entre esses pares de bases de nitrogênio, faça a molécula de DNA adquirir uma estrutura dupla, o que é ideal para sua replicação. Se essas pontes de hidrogênio forem quebradas por aquecimento, a hélice dupla acabará abrindo em dois segmentos ou bandas individuais.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Edward e. Ávila & Asilé J. Amora. (2004). A ponte de hidrogênio e seu link de aplicações. Universidade de Los Andes, Faculdade de Ciências, Departamento de Química.
- Wikipedia. (2020). Ligação de hidrogênio. Recuperado de: em.Wikipedia.org
- Pietri j. & Clark J. (21 de agosto de 2020). Ligação de hidrogênio. Química Librettexts. Recuperado de: química.Librettexts.org
- Os editores da Enyclopaedia Britannica. (2020). Ligação de hidrogênio. Recuperado de: Britannica.com
- Helmestine, Anne Marie, Ph.D. (29 de outubro de 2020). Qual é o exemplo de ligação de hidrogênio? Recuperado de: pensamento.com

