História da teoria cinética molecular, postula e exemplos

- 2378
- 273
- Melvin Mueller
O Teoria cinética molecular É aquele que procura explicar as observações experimentais de gases de uma perspectiva microscópica. Ou seja, tenta associar a natureza e o comportamento das partículas gasosas, com as características físicas do gás como fluido; Explique o macroscópico do microscópico.
Os gases sempre foram objeto de interesse para os cientistas devido a suas propriedades. Eles ocupam todo o volume do recipiente em que estão, sendo capaz de comprimir completamente sem o conteúdo que se opunha à menor resistência; E se a temperatura aumentar, o recipiente começa a se expandir e pode até quebrar.
 Partículas gasosas em condições distantes ou próximas à liquefação. Fonte: Olivier Cleynen e Usuário: Sharayanan [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Partículas gasosas em condições distantes ou próximas à liquefação. Fonte: Olivier Cleynen e Usuário: Sharayanan [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Muitas dessas propriedades e comportamentos estão resumidas nas leis dos gases ideais. No entanto, eles consideram o gás como um todo e não como um conjunto de milhões de partículas dispersas no espaço; Além disso, não fornece dados de pressão, volume e temperatura, mais informações sobre como essas partículas se movem.
É assim que a teoria cinética molecular (TCM) propõe visualizá -los como esferas móveis (imagem superior). Essas esferas colidem entre si e as paredes arbitrariamente e mantêm uma trajetória linear. No entanto, quando a temperatura diminui e a pressão aumenta, a trajetória das esferas se torna curva.
Um gás, de acordo com o TCM, deve se comportar como as esferas da primeira caixa de imagem. Mas, quando esfriou e aumentou a pressão sobre eles, seu comportamento se afasta do ideal. Eles são então gases reais, perto da liquefação e vão para a fase líquida.
Sob essas condições, as interações entre as esferas se tornam mais importantes, a ponto de suas velocidades momentaneamente lentas. Quanto mais próximos eles estão da liquefação, mais curvas suas trajetórias (caixa direita) se tornam, e suas colisões são menos energia.
[TOC]
História
Daniel Bernoulli
A idéia dessas esferas, melhor chamada átomos, já havia sido considerada pelo filósofo romano Lucrécio; Não para gases, mas para objetos sólidos e estáticos. Por outro lado, em 1738 Daniel Bernoulli aplicou a visão atômica a gases e líquidos, imaginando -os como esferas desordenadas se movendo em todas as direções.
Seu trabalho, no entanto, violou as leis da física na época; Um corpo não poderia se mover para sempre, por isso era impossível pensar que um conjunto de átomos e moléculas colidiram entre si sem perda de energia; isto é, a existência de colisões elásticas não foi possível.
Rudolf Clausius
Um século depois, outros autores reforçaram o TCM com um modelo em que partículas gasosas se moviam em uma direção. Rudolf Clausius, no entanto, compilou seus resultados e armou um modelo mais completo do TCM com o qual procurou explicar as leis ideais de Gase demonstradas por Boyle, Charles, Dalton e Avogadro.
Pode atendê -lo: Coulombimetria: Fundamentos, tipos, aplicaçõesJames Clerk Maxwell e Ludwig Boltzmann
Em 1859, James Clerk Maxwell afirmou que as partículas gasosas exibem uma variedade de velocidades a uma determinada temperatura e que um conjunto deles pode ser considerado por meio de uma velocidade molecular média.
Então, em 1871, Ludwig Boltzmann conectou as idéias existentes com entropia e como termodinamicamente sempre tende a ocupar o espaço máximo possível de uma maneira homogênea e espontânea.
Teoria cinética molecular postulada
Considerar o gás de suas partículas, um modelo no qual certos postulados ou suposições são atendidos; postulado que logicamente deve ser capaz de prever e explicar (o mais fiel possível) as observações macroscópicas e experimentais. Dito isto, os postulados do TCM são mencionados e descritos.
O volume de partículas gasosas é insignificante
Em um recipiente cheio de partículas gasosas, elas se dispersam e se afastam entre elas através de todos os cantos. Se por um momento todos pudessem se encontrar em um ponto específico do recipiente, sem liquefação, seria observado que eles mal ocupam uma parte desprezível do volume do contêiner.
Isso significa que no recipiente, mesmo que contenha milhões de partículas gasosas, ele é realmente mais vazio do que completo (proporção de volume-vacío muito menor que 1); Portanto, se suas barreiras permitirem, ele e o gás dentro podem ser comprimidos abruptamente; já que, em conta, as partículas são muito pequenas, assim como o volume deles.
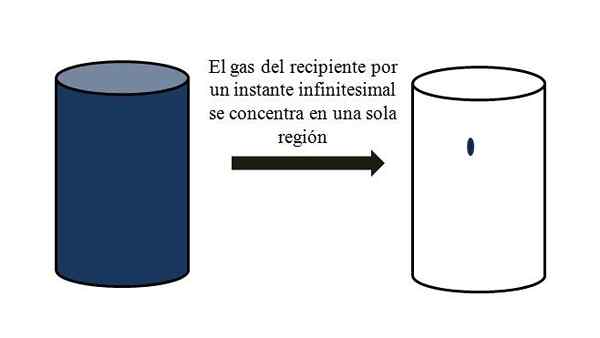 Relação volume-vacío de um gás em um recipiente. Fonte: Gabriel Bolívar.
Relação volume-vacío de um gás em um recipiente. Fonte: Gabriel Bolívar. A imagem superior ilustra com precisão o que é comentado acima, usando um gás azulado.
As forças de atração entre as partículas são nulas
Partículas gasosas dentro do recipiente colidem entre si sem tempo suficiente para que suas interações se tornem força; Ainda menos quando o que os rodeia principalmente é molecular vazio. Uma conseqüência imediata disso é que suas trajetórias lineares permitem que eles cubram completamente o volume do contêiner.
Se o exposto acima não fosse assim, um contêiner "bizarro" e "labiríntico" teria regiões úmidas como resultado da condensação de gás; Em vez disso, as partículas viajam para todo.
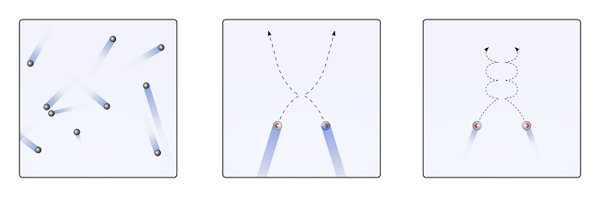
Pode atendê -lo: ácido clorico (hclo3) Despojamentos de partículas gasosas quando as interações são nulas ou insignificantes (para., linear) e quando são importantes (b., curvas). Fonte: Gabriel Bolívar.
Despojamentos de partículas gasosas quando as interações são nulas ou insignificantes (para., linear) e quando são importantes (b., curvas). Fonte: Gabriel Bolívar. As trajetórias lineares da imagem superior (a.) demonstrar este postulado; Enquanto se as trajetórias são curvas (b.), evidência de que existem interações que não podem ser ignoradas entre as partículas.
Partículas gasosas estão sempre em movimento
Dos dois primeiros postulados convergem, além do fato de que as partículas de gás nunca param de se mover. Uma vez borrado no recipiente, eles colidem entre si e com as paredes das mesmas, com uma força e velocidade diretamente proporcionais à temperatura absoluta; Esta força é, a pressão.
Se as partículas gasosas pararem de se mover por um momento, ela seria testemunhada dentro das “línguas de fumaça”, decorrente de nada, com tempo suficiente para se ordenar no vácuo e dar maneiras aleatórias.
As colisões entre as partículas e as paredes do recipiente são elásticas
Se as colisões elásticas entre as partículas gasosas e as paredes do recipiente nunca ocorrerão dentro do recipiente, ele nunca ocorrerá (enquanto as condições físicas não mudarão) a condensação do gás; ou o que é o mesmo que dizer que eles nunca descansam e estão sempre colidindo.
Isso ocorre porque em colisões elásticas não há perda líquida de energia cinética; Uma partícula colide com a parede e salta na mesma velocidade. Se uma partícula quando a colisão diminui a velocidade, os outros aceleram, sem calor ou som que dissipa a energia cinética de qualquer um deles.
A energia cinética não permanece constante
O movimento das partículas é aleatório e caótico, de modo que nem todos carregam a mesma velocidade; Como acontece, por exemplo, em uma rodovia ou em uma multidão. Alguns são mais enérgicos e viajam mais velocidade, enquanto outros são lentos, esperando uma colisão para acelerá -los.
Para descrever sua velocidade, é necessário calcular uma média; E com isso, a energia cinética média das partículas ou moléculas de gás é obtida. Como a energia cinética de todas as partículas está mudando constantemente, a média permite um melhor controle de dados e você pode trabalhar com maior confiabilidade.
A energia cinética média é igual a uma determinada temperatura para todos os gases
Energia cinética molecular média (CEMP) Em um recipiente, é modificado com a temperatura. A uma temperatura mais alta, essa energia será maior. Por ser uma média, pode haver partículas ou refrigerantes com energia maior ou menor em relação a esse valor; alguns mais rápido e mais lento, respectivamente.
Pode atendê -lo: ácidos e bases: diferenças, características, exemplosMatematicamente, pode ser demonstrado que a CEMP Depende exclusivamente da temperatura. Isso significa que não importa o que o gás, sua massa ou estrutura molecular, seu ECMP Será o mesmo em uma temperatura T e só varia se aumentar ou diminuir. De todos os postulos, talvez este seja o mais relevante.
E a velocidade molecular média? Ao contrário do ECMP, A massa molecular influencia a velocidade. Quanto mais pesado a partícula ou molécula de gás, é natural esperar se mover mais lentamente.
Exemplos
Abaixo estão alguns breves exemplos de como o TCM conseguiu dar explicações às leis dos gases ideais. Embora eles não sejam abordados, outros fenômenos, como a disseminação e derrame de gases, também podem ser explicados com o TCM.
Lei de Boyle
Se o volume do recipiente for comprimido a temperatura constante, a distância que as partículas gasosas devem colidir para colidir contra as paredes diminuir; que é igual a um aumento na frequência dessas colisões, resultando em maior pressão. Quando a temperatura é constante, CEMP Também é constante.
Charles Law
Se t, CE aumentaMP vai aumentar. Partículas gasosas se moverão mais rápido e colidirão um número maior de vezes com as paredes do recipiente; aumenta a pressão.
Se as paredes forem flexíveis, capazes de expandir, sua área se tornará maior e a pressão cairá até que se torne constante; E, como resultado, o volume também aumentará.
Lei de Dalton
Se vários litros de gases diferentes fossem adicionados em um recipiente espaçoso, de recipientes menores, sua pressão interna total seria igual à soma das pressões parciais exercidas por cada tipo de gás separadamente.
Porque? Porque todos os gases começam a colidir entre si e dispersam homogeneamente; As interações entre eles são nulos e o vácuo predomina no recipiente (postulados do TCM), então é como se cada gás fosse encontrado sozinho, exercendo sua pressão de maneira individualmente sem a interferência dos outros gases.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning, p 426-431.
- Fernández Pablo. (2019). Teoria cinética molecular. VIX. Recuperado de: VIX.com
- Jones, Andrew Zimmerman. (7 de fevereiro de 2019). Teoria molecular cinética de gases. Recuperado de: pensamento.com
- Hall Nancy. (5 de maio de 2015). Teoria cinética dos gases. Glenn Research Center. Recuperado de: GRC.Panela.Gov
- Blaber m. & Inferior s. (9 de outubro de 2018). Básicos da teoria molecular cinética. Química Librettexts. Recuperado de: química.Librettexts.org
- A teoria molecular cinética. Recuperado de: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Teoria cinética dos gases. Recuperado de: em.Wikipedia.org
- Toppr. (s.F.). Teoria molecular cinética de gases. Recuperado de: TOPPR.com

