Tabela Periódica dos Elementos
- 2296
- 586
- Ernesto Bruen
Qual é a tabela periódica dos elementos?
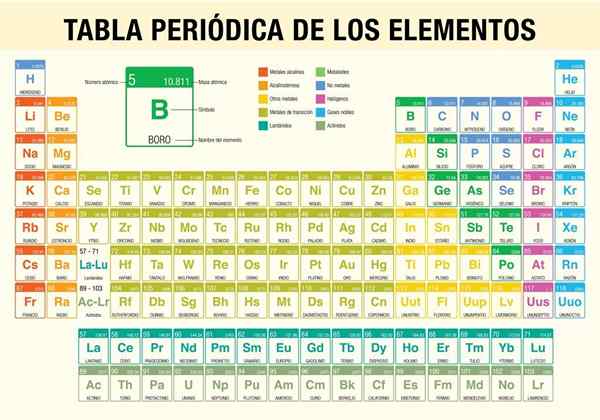
O Tabela Periódica dos Elementos É uma ferramenta que permite consultar as propriedades químicas dos 118 elementos conhecidos até agora. É indispensável ao realizar cálculos estequiométricos, prevendo as propriedades físicas de um elemento, classificando -as e encontrando propriedades periódicas entre todos eles.
Os átomos se tornam mais pesados à medida que seus núcleos adicionam prótons e nêutrons, que também devem ser acompanhados por novos elétrons; Caso contrário, a eletroneutralidade não seria possível. Assim, alguns átomos são muito leves, como hidrogênio, e outros, superpesados, como Oganerson.
Foi o cientista Dmitri Mendeléyev, que em 1869 (quase 150 anos atrás) publicou, após uma década de estudos e experimentos teóricos, a primeira tabela periódica na tentativa de organizar os 62 elementos conhecidos naquele momento.
Qual é a tabela periódica para?
Os principais usos da tabela são:
- Conheça o símbolo e o nome de cada elemento químico que existe.
- Conheça a massa atômica e o número atômico do elemento.
- Informar sobre as relações entre os diferentes elementos.
- Mostrar as diferentes tendências (periodicidade).
- Classificação de tipos de elementos químicos. Esses tipos incluem metais alcalinos, metais básicos, metais de transição, não -metais, gases nobres, halogênios, terras alcalinas, semimetals, actinídeos e lantanídeos.
- Preveja as propriedades de novos elementos ainda não descobertos ou não sintetizados.
Como a tabela periódica é organizada? (Estrutura e organização)
Períodos
Os elementos são ordenados em linhas ou períodos, dependendo do nível de energia de seus orbitais. Antes do período 4, quando os elementos se seguiram em ordem crescente da massa atômica, foi que, para cada oito deles, as propriedades químicas foram repetidas novamente (Lei das oitavas, por John Newlands).
Metais de transição furtados em outros elementos não metálicos, como enxofre e fósforo. Por esse motivo, a entrada de física quântica e configurações eletrônicas para o entendimento das tabelas periódicas modernas era vital.
Os orbitais de uma camada de energia são preenchidos com elétrons (e os núcleos de prótons e nêutrons), à medida que se move ao longo de um período. Essa camada de energia anda de mãos dadas com tamanho atômico ou rádio; Portanto, os elementos dos períodos mais altos são menores do que os encontrados abaixo.
O H e o que eu encontrei no primeiro nível de energia (período); a primeira fila de caixas cinzas, no quarto período; e a fila das caixas de Ananjadas, no sexto período. Observe que, embora o último pareça estar no suposto nono período, ele realmente pertence ao sexto, logo após a caixa amarela de BA.
Grupos
Turnando um período é que a massa, o número de prótons e elétrons aumentam. Na mesma coluna ou grupo, embora a massa e os prótons variem, o número de Elétrons da camada de Valência é o mesmo.
Por exemplo, na primeira coluna ou grupo, o H possui apenas um elétron no 1S Orbital1, Como o Li (2s1), O sódio (3s1), Potássio (4s1) E assim por diante para o Frania (7s1). Esse número 1 indica que esses elementos mal têm um Electron Valência e, portanto, pertencem ao Grupo 1 (AI). Cada elemento está em diferentes períodos.
Sem contar hidrogênio, caixa verde, os elementos sob ele são de caixas laranja e são chamadas de metais alcalinos. Mais uma para a caixa certa em qualquer período, é o grupo ou coluna 2; isto é, seus elementos têm dois elétrons de valência.
Pode atendê -lo: desempenho teóricoMas quando você se move para a direita, sem o conhecimento dos orbitais d, atinge o grupo Boro (b) ou Grupo 13 (iiia); Em vez do Grupo 3 (IIIB) ou Scandio (SC). Levando em consideração o preenchimento dos orbitais D, os períodos das caixas cinza começam a ser percorridas: os metais de transição.
Números de prótons vs elétrons de Valência
Ao estudar a tabela periódica, pode surgir confusão entre o número atômico Z ou o número de prótons totais no núcleo e a quantidade de elétrons de valência. Por exemplo, o carbono possui um z = 6, ou seja, possui seis prótons e, portanto, seis elétrons (caso contrário, não poderia ser um átomo com carga neutra).
Mas, desses seis elétrons, Quatro são de Valência. Por esse motivo, sua configuração eletrônica é [ele] 2s22 p2. [Ele] denota os dois elétrons 1s2 da camada fechada e teoricamente não participa da formação de links químicos.
Além disso, porque o carbono tem quatro elétrons de valência, "convenientemente" está localizado no grupo 14 (IVA) da tabela periódica.
Os elementos abaixo do carbono (sim, ge, sn, pb e fl) têm números atômicos (e atômicos) mais altos; Mas todo mundo tem em comum os quatro elétrons de Valência. Isso é chave para o entendimento de por que um elemento pertence a um grupo e não outro.
Elementos da tabela periódica
Bloco s
Como explicado, os grupos 1 e 2 são caracterizados por ter um ou dois elétrons em orbitais s. Esses orbitais são geometria esférica e, à medida que qualquer um desses grupos é descendente, os elementos estão adquirindo camadas que aumentam o tamanho de seus átomos.
Para apresentar tendências fortes em suas propriedades químicas e maneiras de reagir, esses elementos são organizados como bloco s. Portanto, metais alcalinos e metais alcalinos pertencem a este bloco. A configuração eletrônica dos elementos deste bloco é ns (1s, 2s, etc.).
Embora o elemento de hélio esteja na extremidade superior direita da tabela, sua configuração eletrônica é 1s2 E, portanto, pertence a este bloco.
Bloco p
Ao contrário dos blocos s, os elementos deste bloco apresentam orbitais completamente completos, enquanto seus orbitais P continuam a se encher de elétrons. As configurações eletrônicas dos elementos pertencentes a este bloco são do tipo ns2NP1-6 (Os orbitais p podem ter um ou até seis elétrons para preencher).
Então, em que parte da tabela periódica é este bloco? À direita: as caixas verdes, residentes e azuis; Isto é, elementos não metálicos e metais pesados, como bismuto (BI) e chumbo (PB).
Começando com o Boron, com a configuração eletrônica NS2NP1, Carbono à sua direita adiciona outro elétron: 2s22 p2. Então, as configurações eletrônicas dos outros elementos do período 2 do bloco P são: 2s22 p3 (nitrogênio), 2s22 p4 (oxigênio), 2s22 p5 (Fluoreto) e 2s22 p6 (néon).
Se os períodos mais baixos forem reduzidos, o nível de energia 3: 3s terá23p1-6, E assim por diante até o final do bloco P.
Observe que a coisa mais importante neste bloco é que, do período 4, seus elementos têm orbitais completamente preenchidos (caixas azuis para a direita). Em resumo: o bloco S está à esquerda da tabela periódica e Bloco P, à direita.
Elementos representativos
Quais são os elementos representativos? São aqueles que, por um lado, perdem facilmente elétrons ou, por outro. Em outras palavras: eles são os elementos dos blocos s e p.
Pode atendê -lo: Emulsificante: Processo de Emulsão, Aspectos Moleculares, AplicaçõesSeus grupos se distinguiram dos outros por meio de uma letra A no final. Assim, havia oito grupos: de IA a viiia. Mas atualmente, o sistema de numeração usado em tabelas periódicas modernas é o árabe, de 1 a 18, incluindo metais de transição.
Por esse motivo, o grupo Boro pode ser o IIIA, ou 13 (3+10); o grupo de carbono, IVA ou 14; e o dos gases nobres, o último à direita da mesa, viiia ou 18.
Metais de transição
Metais de transição são todos os elementos das caixas cinza. Ao longo de seus períodos, seus orbitais são preenchidos, que são cinco e, portanto, podem ter dez elétrons. Como dez elétrons devem ter que preencher os orbitais, deve haver dez grupos ou colunas.
Cada um desses grupos no antigo sistema de numeração foi designado com números romanos e uma letra B no final. O primeiro grupo, o do Scandio, foi o IIIB (3), o ferro, o cobalto e o níquel VIIIB por ter reatividades muito semelhantes (8, 9 e 10) e a do zinco IIB (12).
Como pode ser visto, é muito mais fácil reconhecer grupos por números árabes do que usar números romanos.
Metais de transição interna
A partir do período 6 da tabela periódica, os orbitais f começam a estar energeticamente disponíveis. Estes devem ser preenchidos primeiro que os orbitais d; E, portanto, seus elementos geralmente são separados para não estender muito a mesa.
Os dois últimos períodos, laranja e acinzentado. Existem sete orbitais F, que precisam de quatorze elétrons para preencher e, portanto, deve haver quatorze grupos.
Se esses grupos forem adicionados à tabela periódica, haverá 32 no total (18 + 14) e terá uma versão "alongada":
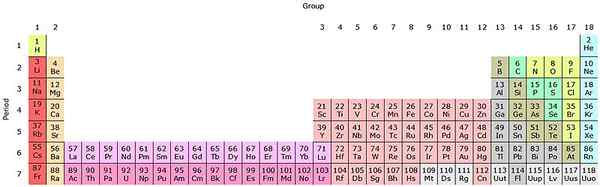 Fonte: por Sandbh [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons
Fonte: por Sandbh [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons A linha rosa clara corresponde aos Lantanoides, enquanto a fila rosa escura os actinoides. O Lantano, o com z = 57, o actinio, ac com z = 89, e todo o bloco f pertence ao mesmo grupo do Scandio. Porque? Porque o Scandio tem um nd orbital1, que está presente no resto dos Lantanoides e Actinoids.
O AC tem configurações 5D de Valencia16s2 e 6d17s2. À medida que você se move para a direita nas duas linhas, os orbitais 4F e 5F começam a preencher. Uma vez cheio, você chega aos elementos Luthacio, Lu e Laurencio, LR.
Metais e não -metais
Deixando o bolo da mesa periódica para trás, é mais conveniente recorrer ao da imagem superior, mesmo em sua forma alongada. No momento, a grande maioria dos elementos acima mencionados tem sido metais.
À temperatura ambiente, todos os metais são substâncias sólidas (exceto mercúrio, líquido) de cinza prateado (exceto cobre e ouro). Eles também são geralmente difíceis e brilhantes; Embora os dos blocos sejam macios e frágeis. Esses elementos são caracterizados pela facilidade de perder elétrons e formar cátions m+.
No caso dos lantanoids, os três elétrons perdem 5D16s2 Para se tornar cátions trivalentes m3+ (como ela3+). A colina, enquanto isso, é capaz de perder quatro elétrons (CE4+).
Por outro lado, elementos não -metálicos compõem a menor parte da tabela periódica. São gases ou sólidos com átomos covalentemente ligados (como enxofre e fósforo). Todos estão localizados no bloco P; Mais precisamente, na parte superior dela, pois descendo para os períodos mais baixos aumenta o caráter metálico (BI, PB, PO).
Além disso, não -metais em vez de perder elétrons, ganha -os. Assim, eles formam ânions x- Com diferentes cargas negativas: -1 para halogênios (grupo 17) e -2 para calcógenos (grupo 16, oxigênio).
Pode servir a você: álcool etílico: estrutura, propriedades, usos, obtençãoFamílias de metal
Dentro dos metais, há uma classificação interna para diferenciá -los de:
- O grupo 1 metais são alcalinos.
- Grupo 2, Metais Alkalinerrior (SR. Scholambara).
- Grupo 3 (IIB) Família Scandio. Esta família é composta pelo Scandio, Chefe de Grupo, do Ititrium e, do Lantano, Actinio e todos os Lantanoides e Actinoides.
- Grupo 4 (IVB), Família Titanium: TI, ZR (Circonium), HF (Hafnio) e RF (Rutherfordio). Quantos elétrons de valência têm? A resposta está em seu grupo.
- Grupo 5 (VB), família Vanadio. Grupo 6 (VIB), família Chrome. E assim por diante para a família de zinco, grupo 12 (IIB).
Metalóides
O caráter metálico aumenta da direita para a esquerda e de cima para baixo. Mas qual é a fronteira entre esses dois tipos de elementos químicos? Esta borda é composta por elementos conhecidos como metalóides, que têm características de metais e não -metais.
Os metalóides podem ser vistos na tabela periódica na "escada" que começa com o boro e termina no elemento radioativo astato. Esses elementos são:
- B: Boro.
- Silício: Sim.
- GE: Germanio.
- AS: Arsênico.
- SB: Antimônio.
- TE: Telurio.
- AT: Astato.
Cada um desses sete elementos exibe propriedades intermediárias, que variam de acordo com o ambiente químico ou a temperatura. Uma dessas propriedades é a semicondução, ou seja, os metalóides são semicondutores.
Gases
Em condições terrestres, os elementos gasosos são aqueles metais não -iluminados, como nitrogênio, oxigênio e fluorina. Além disso, cloro, hidrogênio e gases nobres entram nesta classificação. De todos eles, os mais emblemáticos são os gases nobres, por sua baixa tendência a reagir e se comportar como átomos livres.
Este último é encontrado no grupo 18 da tabela periódica e são:
- Helio, ele.
- Neon, NE.
- Argon, AR.
- Kripton, KR.
- Xenón, Xe.
- Radón, rn.
- E o mais recente de tudo, o nobre gás oganeso sintético, OG.
Todos os gases nobres têm em comum a configuração do Valência2NP6; isto é, eles completaram o octeto de Valência.
Agregação declara para outras temperaturas
Os elementos estão em estado sólido, líquido ou gasoso, dependendo da temperatura e força de suas interações. Se a temperatura da Terra esfriar até que o zero absoluto (0k) esteja por perto, todos os elementos congelariam; Exceto pelo hélio, que condensaria.
Nesta temperatura extrema, o restante dos gases estaria na forma de gelo.
No outro extremo, se a temperatura fosse de aproximadamente 6000k, "todos" os elementos estariam em um estado gasoso. Sob essas condições, nuvens de ouro, prata, chumbo e outros metais poderiam literalmente observar.
Importância da tabela periódica
Atualmente, a tabela periódica é o instrumento organizacional mais importante da química devido às relações detalhadas de seus elementos. Seu uso é essencial para estudantes e professores e para pesquisadores e muitos profissionais dedicados ao ramo de química e engenharia.
Apenas olhando para a tabela periódica, uma quantidade imensa e as informações são obtidas de maneira rápida e eficaz, como:
- Lítio (Li), berílio (BE) e boro (b) conduzem eletricidade.
- O lítio é um metal alcalino, o berílio é um alcalino -metal e o boro não é metal.
- O lítio é o melhor motorista dos três nomeados, seguidos por Beryllium e, finalmente, Boron (semicondutor).
Assim, ao localizar esses elementos na tabela periódica, sua tendência à condutividade elétrica pode ser concluída instantaneamente.