Tabela quântica
- 1899
- 564
- Alfred Kub
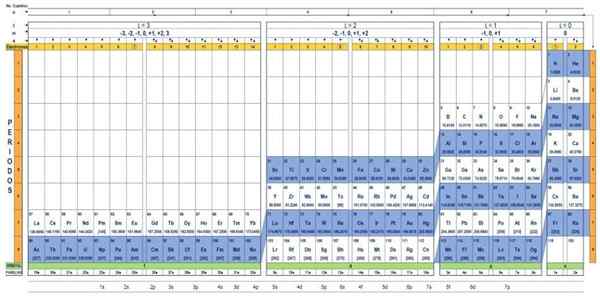
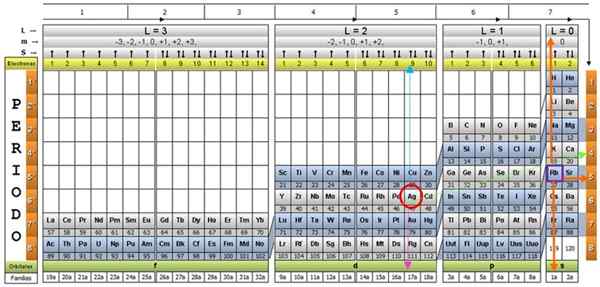
 A tabela quântica dos elementos. Fonte: UNAM.
A tabela quântica dos elementos. Fonte: UNAM. Qual é a tabela quântica?
O Tabela quântica É uma maneira de organizar os elementos químicos, projetados para determinar facilmente o conjunto de números quânticos que caracterizam cada um deles.
Os cientistas descobriram que, na natureza de todos os elementos, existem certos padrões. Entre esses padrões estão os números quânticos, quatro números simples que descrevem a configuração eletrônica de cada elemento.
Os números quânticos surgem naturalmente do modelo mecânico-mecânico do átomo e são indicados por cartas: n, ℓ, mℓ e s. Eles descrevem o status de energia dos elétrons no átomo de cada elemento químico.
Através da tabela periódica tradicional e algumas ferramentas adicionais, é possível ter a configuração eletrônica do átomo de qualquer elemento. A vantagem da tabela quântica é que os elementos são organizados de tal maneira que seus números quânticos são imediatamente visíveis, sem a necessidade de fazer vários cálculos separadamente.
Características da tabela quântica
Existem vários designs de tabelas quânticas. O modelo mostrado na figura acima contém:
- Um cabeçalho com quatro linhas, com os valores dos quatro números quânticos, N, ℓ, M e S, mais uma quinta fila em amarelo, que corresponde ao número de elétrons no orbital mais externo.
- O corpo da mesa, que consiste em uma grade que contém o símbolo do elemento químico, começando com o hidrogênio, na penúltima coluna da direita, seguida pelo hélio, e assim por diante. O número abaixo representa a quantidade de elétrons atômicos em um estado fundamental.
- Na parte inferior, na linha verde, existem quatro classes para organizar os elementos: os orbitais S, P, D e F (da esquerda para a direita).
- Finalmente, sob a linha orbital é a família. Cada coluna é uma família, numerada de 1 a 32. Por exemplo, 1ª e 2ª famílias pertencem à classe S, as famílias de 3º a 8a pertencem à classe P e assim por diante.
Qual é a tabela quântica para?
A tabela quântica serve para encontrar o conjunto de números quânticos que caracterizam um elétron do átomo. Normalmente, esses elétrons serão os da camada mais externa, pois são os que definem o comportamento químico do elemento.
Como está a tabela quântica?
A tabela quântica permite encontrar facilmente os números quânticos dos elétrons na camada mais externa do átomo.
Exemplo 1
Para ilustrar o procedimento, o elemento de alumínio é tomado como um exemplo, cujo símbolo é para o. O primeiro passo é localizá -lo na mesa quântica, marcando -o com um círculo vermelho:
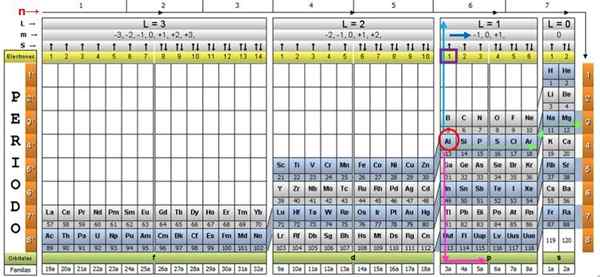
Etapa 1: Encontre n
Depois de localizar o elemento na tabela, você deve se mover através da mesma linha e cor, para a direita, até chegar à coluna laranja, seguindo a estrada da seta verde mostrada na imagem.
A seta aponta para a caixa marcada com o número 3, que é o principal número quântico n:
n = 3
Etapa 2: Encontre ℓ
Para determinar o número quântico secundário, a seta vertical azul é seguida, o que indica:
ℓ = 1.
Etapa 3: Encontre m
O elétron de alumínio externo é encontrado na família Pubilling P, como pode ser lido na linha verde, na qual os pontos de seta rosa.
Além disso, a quantidade de elétrons na última camada é lida na linha amarela do cabeçalho. No caso de alumínio, há 1 elétron (destacado no quadrado roxo), que é a referência. Combinando os resultados acima, a configuração da última camada é:
Pode servir a você: célula galvânica: partes, como funciona, aplicações, exemplos3p1
Sabe -se que uma camada P suporta um máximo de 6 elétrons. E o número m leva alguns dos valores inteiros - ℓ, ( - ℓ+1),… 0,… (+ℓ −1),+ℓ.
Como neste caso ℓ = 1, então M pode ser -1, 0, 1.
Esses números aparecem na fila do cabeçalho correspondente a m (veja na imagem Arrow horizontal azul). A tabela a seguir serve como um guia para saber qual é o valor da escolha, dependendo do caso:
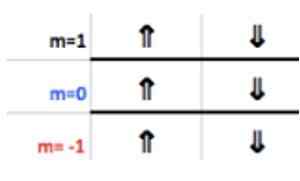
Como a última camada de alumínio possui 1 elétron, o número quântico magnético corresponde
M = 1.
Etapa 4: Encontre s
O número de spin s tem apenas dois valores: +½ ou - ½. Na caixa superior, se a seta indicar, será escolhida S = +½ e se for apontada, então S = - ½. No caso de alumínio, o Electron 1 aponta, portanto:
S = + ½.
Em suma, o número quântico do elétron da camada mais externa de alumínio ao som:
n = 3; ℓ = 1; M = 1, S = +½
Exemplo 2 (casos excepcionais)
Silver AG, e cerca de vinte mais elementos, são casos excepcionais, portanto os cuidados devem ser tomados ao usar a tabela quântica com eles.
Se o procedimento anterior for repetido, a AG será obtido como um último sub -nível no 4D9.
Isso ocorre porque a configuração prevista de La Plata, pelo governo de Madelung, é:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9
No entanto, na prática AG não segue exatamente essa configuração, nem outros elementos cuja última camada prevista é 4D9, como cobre e ouro, entre outros (consulte a Internet para obter uma lista completa de elementos que não seguem a regra de Madelung).
Pode atendê -lo: molalidadeA verdadeira configuração da AG é:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Em que um elétron da camada 5S2 saltou para a camada 4D9 para completá -lo. Dessa maneira, a estabilidade do átomo aumenta. Portanto, o último sub -nível realmente é:
5s1
E seus números quânticos seriam aqueles correspondentes ao elemento RB, mostrado em uma caixa roxa, com setas laranja apontando para os números restantes:
n = 5; ℓ = 0; m = 0; S = +½
 Revendo a tabela periódica, com efeito, é visto que a AG está no período 5, uma característica determinada pelo número quântico principal n.
Revendo a tabela periódica, com efeito, é visto que a AG está no período 5, uma característica determinada pelo número quântico principal n.
Diferenças com a tabela periódica
Ambas as tabelas são duas maneiras de organizar os elementos químicos de acordo com as características de seus átomos:
-Na tabela periódica, os elementos encontrados na mesma coluna têm propriedades químicas semelhantes. Por exemplo, começa com a coluna metais alcalinos à esquerda e termina a dos gases nobres à direita. Enquanto nas fileiras estão os elementos com o mesmo nível mais alto de energia.
-A tabela quântica tem uma disposição escalonada, projetada de acordo com as regras de preenchimento. Portanto, você deve seguir as etapas para obter o número quântico principal, exceto no caso de exceções como a prata, no exemplo da seção anterior. As famílias de elementos nesta tabela estão relacionadas através do orbital superior, em S, P, D ou F.
Referências
- Chang, R. 2013. Química. 11VA. Edição. Educação de McGraw Hill.
- Configuração eletronica. Configuração eletrônica e números quânticos. Recuperado de: ConfiguioneCetranica.com.
- Manual de Química. Recuperado de: DCB.Engenharia.Unam.mx.
- Química Oficial. Como facilitar números quânticos fáceis. Recuperado de: Chemistry Official.com
- Triplenlace. Exceções à regra de Madelung na configuração eletrônica de elementos químicos. Recuperado de: Triplenlace.com.

