Efeitos de substituição nucleofílica aromática, exemplos
- 4899
- 1241
- Ralph Kohler
O Substituição nucleofílica aromática (SNAR) é uma reação que ocorre na química orgânica, que consiste no deslocamento de um bom grupo de saída por um nucleofil de entrada. Do ponto de vista de seu mecanismo e aspectos eletrônicos, é a face oposta da substituição eletrofílica aromática (Sear).
Geralmente o grupo de saída é um halogênio, que sai como haluro x ânion-. Essa reação só pode ocorrer se o anel aromático (principalmente benzeno) for deficiente em elétrons; isto é, se você tiver grupos substituintes de atrator eletrônicos.
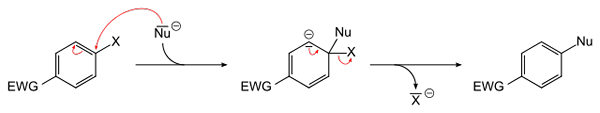
 Equação geral para uma substituição nucleofílica aromática. Fonte: Sponk [domínio público]
Equação geral para uma substituição nucleofílica aromática. Fonte: Sponk [domínio público] A imagem superior esquematiza o que foi dito no parágrafo anterior. O EWG Electron Atrator Group (para seu acrônimo em inglês: Grupo de retirada de elétrons), ativa o anel aromático para o ataque nucleofílico da espécie negativa da nu-. Pode -se observar que um intermediário é formado (no centro), a partir do qual o haluro x é liberado ou liberado-.
Observe que, em termos x simples, é substituído por Nu em um anel aromático. Essa reação é muito versátil e necessária na síntese de novos medicamentos, bem como em estudos de química orgânica sintética.
[TOC]
Aspectos gerais
O anel aromático pode ser "carregado" ou "download" de elétrons, dependendo de seus substituintes (aqueles que substituem o link C-h original).
Quando esses substituintes podem doar densidade eletrônica ao anel, diz -se que eles o enriquecem de elétrons; Se, pelo contrário, eles são atratores de densidade eletrônica (o EWG mencionado acima), diz -se então que empobrecem o anel de elétrons.
De qualquer forma, o anel é ativado para uma reação aromática específica, enquanto é desativado para o outro.
Por exemplo, diz -se que um anel aromático rico em elétrons é ativo para a substituição eletrofílica aromática; Isto é, você pode doar seus elétrons para uma espécie de eletrofilato e+. No entanto, não doará elétrons para uma espécie nu-, Como cargas negativas se repeliriam.
Pode atendê -lo: teoria orbital molecularAgora, se o anel é pobre em elétrons, não tem como entregá -los à espécie e+ (Sear não ocorre); Em vez disso, é disponibilidade aceitar os elétrons da espécie nu- (SNAR se desenvolve).
Diferenças com substituição eletrofílica aromática
Esclareceu os aspectos gerais da entrada, algumas diferenças entre o SNAR e o sear agora podem ser listadas:
- O anel aromático atua como um eletrofilo (elétrons pobres) e é atacado por um nucleófilo.
- Um grupo X é substituído do anel; Não um h+
- Nenhuma carboca é formada, mas intermediários com uma carga negativa que pode ser realocada pela ressonância
- A presença de grupos mais atraentes no anel acelera a substituição em vez de desacelerar
- Finalmente, esses grupos não exercem diretores em onde (em que carbono) a substituição ocorrerá. A substituição sempre ocorrerá em carbono ligado ao grupo de saída X.
O último ponto também é ilustrado na imagem: o link C-X é quebrado para formar o novo link C-NU.
Efeitos
Do número de substituintes
Naturalmente, os mais pobres em elétrons são o anel, mais rápido o rosnado e o menos drástico serão as condições necessárias para que ocorra. Considere o exemplo a seguir representado na imagem inferior:
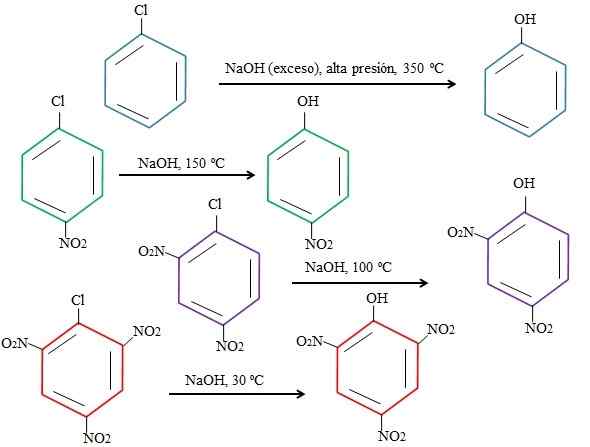 Efeitos de substituintes nas substituições de 4-nitroclorobenzeno. Fonte: Gabriel Bolívar.
Efeitos de substituintes nas substituições de 4-nitroclorobenzeno. Fonte: Gabriel Bolívar. Observe que o 4-nitroclorobenzeno (anel azul) requer condições drásticas (alta pressão e uma temperatura de 350 ºC) à substituição do CL por. Nesse caso, o cloro é o grupo de saída (CL-) e o hidróxido nucleófilo (oh-).
Pode servir a você: 4 períodos de química: da pré -história até hojeQuando o grupo não aparece2, que é um atrator eletrônico (anel verde), a substituição pode ser realizada a uma temperatura de 150 ºC à pressão ambiente. À medida que o número de grupos aumenta não2 Presente (anéis roxos e vermelhos), a substituição ocorre em temperaturas cada vez mais baixas (100 ºC e 30ºC, respectivamente).
Portanto, grupos não2 Eles aceleram o rosnado e desbaste de elétrons para o anel, tornando -o mais suscetível ao ataque de OH-.
As posições relativas do CL não serão explicadas aqui em relação a não2 no 4-nitroclorobenzeno e como eles alteram a velocidade da reação; Por exemplo, as velocidades de reação do 2-nitroclorobenzeno e 3-nitroclorobenzeno são diferentes, sendo este último o mais lento em comparação com os outros isômeros.
Do grupo de saída
Voltando ao 4-nitroclorobenzeno, sua reação de substituição é mais lenta se você comparar o de sua contraparte fluoredorada:
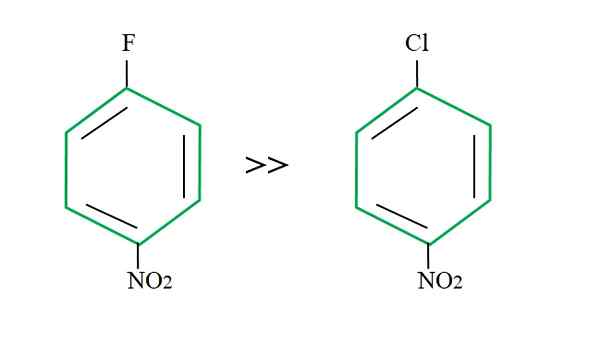 Efeito do grupo de saída nas reações de rosnamento. Fonte: Gabriel Bolívar.
Efeito do grupo de saída nas reações de rosnamento. Fonte: Gabriel Bolívar. A explicação disso não pode estar em outra variável de que a diferença entre F e Cl. Fluorine é um grupo de saída ruim, porque o link C-F é mais difícil de quebrar do que o link C-Cl. Portanto, o colapso deste link não é a etapa determinante da velocidade do rosnado, mas a adição do nu- para o anel aromático.
O flúor por ser mais eletronegativo que o cloro, o átomo de carbono ligado a ele tem maior deficiência eletrônica (cδ+-Fδ-). Consequentemente, o carbono do link C-F tem muito mais probabilidade de ser atacado por Nu- do que o link C-Cl. É por isso que a substituição de F por OH é muito mais rápida que a de Cl por OH.
Pode atendê -lo: sulfeto de cobre: estrutura, propriedades, usosExemplo
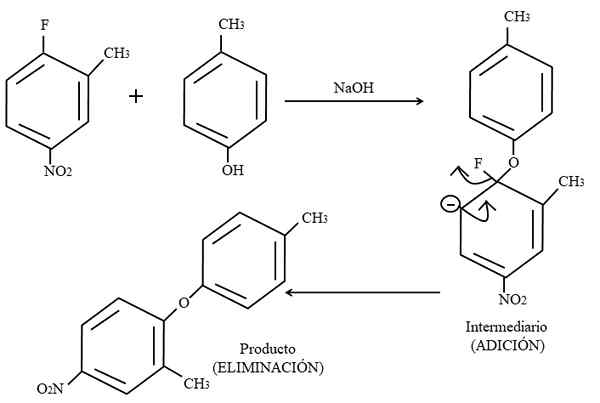 Substituição eletrofílica aromática. Fonte: Gabriel Bolívar.
Substituição eletrofílica aromática. Fonte: Gabriel Bolívar. Finalmente, um exemplo desse tipo de reação orgânica na imagem mais alta é mostrada abaixo. O para-coresool não dá a aparência de ser um nucleófilo; Mas tendo um meio básico, seu grupo OH não é protegido, deixando um ânion fenóxido, que atacam o 2-metil-4-nitrofluorzeno.
Quando esse ataque ocorre, diz -se que o nucleófilo é adicionado ao eletrofilo. Esta etapa pode ser vista à direita da imagem, onde o composto intermediário com ambos os substituintes pertencentes ao anel é formado.
Ao adicionar para-coreres, aparece uma carga negativa que realoca a ressonância dentro do anel (observe que deixa de ser aromático).
Na imagem, a mais recente estrutura de ressonância é mostrada mal, a partir da qual o flúor é finalizado como f-; Mas, na realidade, essa carga negativa se torna desocupada mesmo nos átomos de oxigênio do grupo2. Após a adição da eliminação, o último, que é quando o produto é finalmente formado.
Comentário final
O grupo não2 restante pode ser reduzido ao grupo NH2, E a partir daí é possível fazer mais reações de síntese para modificar a molécula final. Isso mostra o potencial sintético do rosnado, e que seu mecanismo, além disso, consiste em duas etapas: uma de adição e a de eliminação.
Atualmente, no entanto, existem evidências experimentais e computacionais de que, na realidade, a reação prossegue após um mecanismo concertado, onde ambas as etapas ocorrem simultaneamente através de um complexo ativado e não por um intermediário.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.
- Wikipedia. (2019). Substituição aromática nucleofílica. Recuperado de: em.Wikipedia.org
- James Ashenhurst. (6 de setembro de 2019). Substituição aromática nucleofílica (NAS). Recuperado de: MasterorganicChemistry.com
- Química Librettexts. (5 de junho de 2019). Substituição aromática nucleofílica. Recuperado de: química.Librettexts.org

