Estrutura de sulfeto de alumínio (Al2S3), propriedades, usos
- 1023
- 187
- Gilbert Franecki
Ele Sulfeto de alumínio (Para o2S3) É um composto químico cinza claro formado pela oxidação do alumínio metálico ao perder os elétrons do último nível de energia e se tornar um cátion, e pela redução de enxofre não metálico, ganhando elétrons transferidos pelo alumínio e se tornando um ânion.
Para que isso aconteça e o alumínio pode produzir seus elétrons, é necessário que você apresente três orbitais híbridos sp3, que dão a possibilidade de formar links para elétrons a partir de enxofre.
A sensibilidade ao sulfeto de alumínio da água implica que, na presença de vapor de água encontrado no ar, pode reagir a produção de hidróxido de alumínio (Al (OH)3), sulfeto de hidrogênio (H2S) e hidrogênio (h2) gasoso; Se o último acumular pode causar uma explosão. Portanto, a embalagem de sulfeto de alumínio deve ser feita usando recipientes herméticos.
Por outro lado, como o sulfeto de alumínio tem reatividade com água, isso o torna um elemento que não tem solvente solvente.
Estrutura química
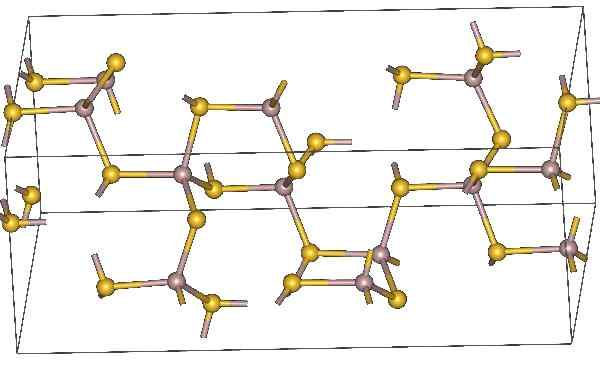
 Estrutura química do sulfeto de alumínio. Átomos amarelos representam enxofre. Fonte: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons
Estrutura química do sulfeto de alumínio. Átomos amarelos representam enxofre. Fonte: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons Fórmula molecular
Para o2S3
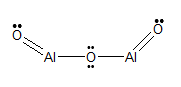
Fórmula estrutural
 Nomenclatura
Nomenclatura
- Sulfeto de alumínio.
- DI trissulfeto de alumínio.
- Sulfeto de alumínio (III).
- Sulfeto de alumínio.
Propriedades do sulfeto de alumínio
 Aparência de sulfeto de alumínio
Aparência de sulfeto de alumínio Compostos químicos exibem principalmente dois tipos de propriedades: físico e químico.
Propriedades físicas
Massa molar
150.158 g/mol
Densidade
2.02 g/ml
Ponto de fusão
1100 ° C
Solubilidade em água
Insolúvel
Propriedades quimicas
Uma das principais reações de sulfeto de alumínio é com água, como substrato ou principal reativa:

Nesta reação, a formação de hidróxido de alumínio e a do sulfeto de hidrogênio pode ser observada se estiver na forma de gás ou ácido sulfeto se for dissolvido na água na forma de uma solução. Sua presença é identificada pelo cheiro de ovos podres.
Pode atendê -lo: soluções químicasUsos e aplicações
Em Super CardPisors
O sulfeto de alumínio é usado na fabricação de estruturas de nano -redes que melhoram a área superficial específica e a condutividade elétrica, para que uma alta capacitância e densidade de energia possam ser alcançadas cuja aplicabilidade é a de supercaugadas.
Óxido de grafeno (GO) - O grafeno é uma das formas almotrópicas de carbono - serviu como suporte de sulfeto de alumínio (Al2S3) Com uma morfologia hierárquica semelhante à de Nanorambután fabricada usando o método hidrotérmico.
Ação de óxido de grafeno
As características do óxido de grafeno como suporte, bem como alta condutividade elétrica e área de superfície, fazem o nanorambutano2S3 ser eletroquimicamente ativo.
As curvas específicas de capacitância CV com picos redox bem definidos confirmam o comportamento pseudocapacitivo do nanorambutano2S3 hierárquico, sustentado em óxido de grafeno em eletrólito NaOH 1M. Os valores específicos de capacitância CV obtidos das curvas são: 168,97 na velocidade de exploração de 5mv/s.
Além disso, foi observado um bom tempo de descarga galvanostático de 903 µs, uma grande capacitância específica de 2178.16 para a corrente de 3 Ma/cm de corrente2. A densidade de energia calculada a partir da descarga galvanostática é de 108,91 wh/kg, até a densidade de corrente de 3 mA/cm2.
A impedância eletroquímica confirma assim a natureza pseudocapacitiva do eletrodo hierárquico nanorambutano para o2S3. O teste de estabilidade do eletrodo mostra uma retenção de 57,84 % da capacitância específica de até 1000 ciclos.
Resultados experimentais sugerem que nanorambutane2S3 Hierárquico é adequado para aplicações de supercaidir.
Pode servir a você: hidróxido de cromo: estrutura, propriedades, síntese, usosEm baterias secundárias de lítio
Com a intenção de desenvolver uma bateria secundária de lítio com alta densidade de energia, o sulfeto de alumínio foi estudado (Al2S3) como material ativo.
A medida inicial de capacidade de download2S3 Era aproximadamente 1170 mAh G-1 a 100 M G-1. Isso corresponde a 62 % da capacidade teórica de sulfeto.
Al2S3 Ele exibiu baixa retenção de capacidade na faixa potencial entre 0,01 V e 2,0 V, principalmente devido à irreversibilidade estrutural do processo de carga ou à extração de Li.
Análise de DRX e K-Xes para alumínio e enxofre indicou que a superfície de Al2S3 reage reversivelmente durante os processos de carregamento e descarregamento, enquanto o núcleo de Al2S3 Ele mostrou irreversibilidade estrutural, porque lial e li2S foram formados de Al2S3 No download inicial e então eles permaneceram como eram.
Riscos
- Em contato com a água libera gases inflamáveis que podem queimar espontaneamente.
- Causar irritação na pele.
- Causar irritação ocular grave.
- Pode causar irritação respiratória.
As informações podem variar entre notificações, dependendo de impurezas, aditivos e outros fatores.
Procedimento de primeiros socorros
Tratamento geral
Procure atendimento médico se os sintomas persistirem.
Tratamento especial
Nenhum
Sintomas importantes
Nenhum
Inalação
Leve a vítima para fora. Fornecimento de oxigênio se a respiração for difícil.
Ingestão
Gerenciar um ou dois copos de água e induzir vômitos. Nunca induz vômito ou dando nada na boca a uma pessoa inconsciente.
Pelagem
Lave a área afetada com sabão macia e água. Exclua qualquer roupa contaminada.
Olhos
Lave os olhos com água, piscando frequentemente por vários minutos. Remova as lentes de contato, caso você as tenha e continue a enxaguar.
Pode atendê -lo: Cruzeiro para Crucible: Características, Funções, Use ExemplosMedidas de combate a incêndio
Inflamabilidade
Não inflamável.
Meios de extinção
Reaja com água. Não use água: use CO₂, areia e extintor de poeira.
Procedimento de luta
Use um aparelho de respiração autônoma com proteção completa. Use roupas para evitar o contato com a pele e os olhos.
Referências
- Saúde e riscos.com, (S.f), definição, conceitos e artigos sobre saúde, riscos e meio ambiente. Recuperado: saúde e riscos.com
- Sulfeto de alumínio. (s.F). Em Wikiwand. Recuperado em 9 de março de 2018: Wikiwand.com
- Elementos da web.(s.F).Trisulpfide de dialuminium, recuperado em 10 de março de 2018: WebElements.com
- LTS Research Laboratories, Inc (2016), Sulfeto de Alumínio de Dados de Segurança: Ltschem.com

