Ponto Triplo
- 2961
- 550
- Conrad Schmidt
Qual é o ponto triplo?
Ele Ponto Triplo É um termo no campo da termodinâmica que se refere à temperatura e pressão em que existem simultaneamente três fases de uma substância em um estado de equilíbrio termodinâmico. Esse ponto existe para todas as substâncias, embora as condições em que elas são alcançadas variem muito entre cada.
Um ponto triplo também pode envolver mais de uma fase do mesmo tipo para uma substância específica; isto é, duas fases sólidas, fluidas ou gasosas diferentes são observadas. O hélio, em particular seu isótopo Helio-4, é um bom exemplo de um ponto triplo envolvendo duas fases de fluido individuais: fluido normal e supérfluo.
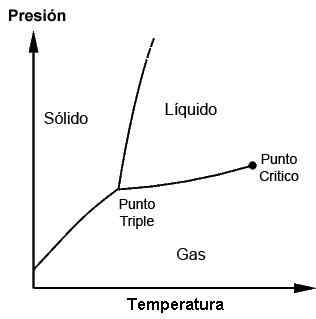
 Diagrama de fases mostrando o ponto triplo e o ponto crítico
Diagrama de fases mostrando o ponto triplo e o ponto crítico Para que é e quando o ponto triplo é usado?
O ponto triplo da água é usado para definir o Kelvin, a unidade de base termodinâmica de temperatura no Sistema Internacional de Unidades (SI). Este valor é definido por definição em vez de medida.
Os pontos triplos de cada substância podem ser observados com o uso de diagramas de fase, que são plotados gráficos que permitem demonstrar as condições limitantes das fases sólidas, líquidas e gasosas (e outras, em casos especiais) de uma substância enquanto exercem mudanças nas mudanças em temperatura, pressão e/ou solubilidade.
Uma substância pode ser encontrada em seu ponto de fusão em que o sólido encontra o líquido; Também pode ser encontrado em seu ponto de ebulição em que o líquido encontra o gás. No entanto, é no ponto triplo onde as três fases são alcançadas. Esses diagramas serão diferentes para cada substância, como será visto mais tarde.
Pode atendê -lo: API Gravity: escala e classificação do petróleo brutoO ponto triplo pode ser usado efetivamente na calibração dos termômetros, usando células de ponto triplo.
São amostras de substâncias em condições isoladas (dentro de "células" de vidro) que estão em seu ponto triplo com condições de temperatura e pressão conhecidas e, assim, facilitam o estudo da precisão das medições do termômetro.
O estudo desse conceito na exploração do planeta Marte também foi usado, no qual o nível do mar foi tentado durante missões que foram realizadas na década de 1970.
Água tripla
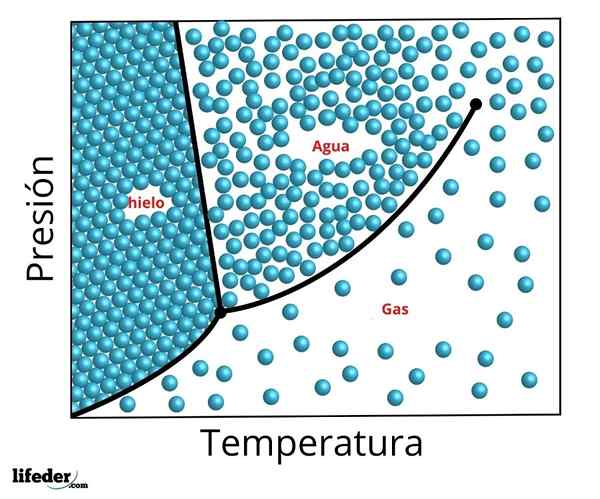 Diagrama de fases do ponto triplo da água. O ponto triplo é o ponto inferior e o crítico o ponto superior
Diagrama de fases do ponto triplo da água. O ponto triplo é o ponto inferior e o crítico o ponto superior As condições precisas de pressão e temperatura nas quais a água coexiste em suas três fases em equilíbrio - água líquida, gelo e vapor - ocorrem a uma temperatura de exatamente 273,16 K (0,01 ºC) e uma pressão parcial do vapor de vapor 611.656 Pascals (0,0060659 atm ).
Neste ponto, é possível converter a substância em qualquer uma das três fases com mudanças mínimas em sua temperatura ou pressão. Mesmo quando a pressão total do sistema pode estar localizada acima da necessária para o ponto triplo, se a pressão parcial do vapor estiver em 611.656 pa, o sistema atingirá o ponto triplo da mesma maneira.
É possível observar na figura anterior a representação do ponto triplo (ou Ponto Triplo, em inglês) de uma substância cujo diagrama é semelhante ao da água, de acordo com a temperatura e a pressão necessárias para atingir esse valor.
No caso da água, esse ponto corresponde à pressão mínima na qual a água líquida pode existir. Para pressionar menor a esse ponto triplo (por exemplo, no vácuo) e quando um aquecimento constante de pressão é usado, o gelo sólido se converte diretamente em vapor de água sem passar pelo líquido; Este é um processo chamado sublimação.
Pode servir a você: Teoria do Big Bang: características, estágios, evidências, problemasAlém dessa pressão mínima (PTp), o gelo primeiro derreterá para formar água líquida e só lá evaporará ou ferverá para formar vapor.
Para muitas substâncias, o valor da temperatura em seu ponto triplo é a temperatura mínima na qual a fase líquida pode existir, mas isso não acontece no caso da água. Para a água, isso não acontece, já que o ponto de fusão do gelo diminui com base na pressão, como mostrado com a linha pontilhada verde da figura anterior.
Em fases de alta pressão, a água possui um diagrama de fases bastante complexo, que mostra quinze fases de gelo conhecidas (em diferentes temperaturas e pressões), além de dez pontos triplos diferentes que são exibidos na figura a seguir:
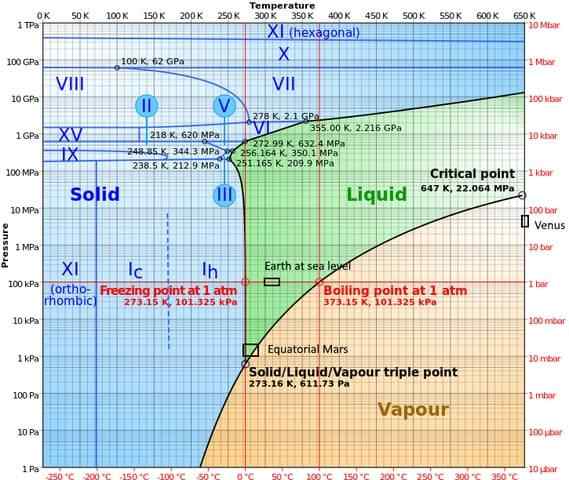
Pode -se notar que, em condições de alta pressão, o gelo pode existir em equilíbrio com o líquido; O diagrama mostra que os pontos de fusão aumentam com a pressão. Em baixas temperaturas constantes e aumento da pressão, o vapor pode ser transformado diretamente em gelo, sem passar pela fase líquida.
As diferentes condições que ocorrem nos planetas onde o ponto triplo (terra no mar e na área equatorial de Marte) também são representados neste diagrama).
O diagrama deixa claro que o ponto triplo varia dependendo do local por razões de pressão e temperatura atmosférica, e não apenas pela intervenção do experimentador.
Ponto triplo do ciclohexano
A ciclohexana é um ciclocano que tem a fórmula molecular de C6H12. Esta substância tem a peculiaridade de ter condições triplas de ponto que podem ser facilmente reproduzidas, como no caso da água, uma vez que esse ponto está localizado a uma temperatura de 279,47 K e uma pressão de 5.388 kPa.
Pode servir a você: cobranças ao vivo: conceito, características, exemplosSob essas condições, o composto hirar, solidificando e derretido com mudanças mínimas de temperatura e pressão.
Ponto benzeno triplo
Em um caso semelhante ao ciclohexano, o benzeno (composto orgânico com a fórmula química C6H6) tem condições de ponto triplo facilmente reproduzível em um laboratório.
Seus valores são 278,5 K e 4,83 kPa, então a experimentação com esse nível de iniciante também é comum.
Referências
- Wikipedia. (s.F.). Wikipedia. Obtido de in.Wikipedia.org
- Britannica, e. (1998). Enciclopédia Britannica. Obtido da Britannica.com
- Poder, n. (s.F.). Energia nuclear. Obtido da potência nuclear.líquido
- Wagner, w., Saul, a., & Prub, para. (1992). Equações internacionais para a pressão ao longo da fusão e ao longo da curva de sublimação da água comum. Bochum.
- PENONCELLO, S. G., Jacobsen, r. T., & Goodwin, um. R. (novecentos e noventa e cinco). Para formulação de propriedade termodinâmica para ciclohexano.

