Estrutura de sulfato de cobre (CUSO4), propriedades, obtenção, uso
- 4077
- 19
- Shawn Leffler
Ele sulfato de cobre É um composto inorgânico formado pelos elementos de cobre (Cu), enxofre (s) e oxigênio (O) (O). Sua fórmula química é Cuso4. O cobre está em um estado de oxidação +2, enxofre +6 e oxigênio tem valência -2.
É um sólido branco que, quando é exposto à umidade do meio ambiente, se torna seu pentahidrato azul de Cuso Blue4 •5h2QUALQUER. O sólido branco é obtido aquecendo o azul para eliminar a água.
 Sulfato de cobre (CuO4) anidro (sem água em sua estrutura cristalina). C. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Sulfato de cobre (CuO4) anidro (sem água em sua estrutura cristalina). C. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. Tem sido usado como agente antibacteriano há séculos para curar feridas em humanos e animais. Ele também funciona como fungicida, como um adstringente, antidiarréico e controlando doenças intestinais em animais. Também é usado como um agente antihongos em plantas.
No entanto, alguns de seus usos foram descontinuados porque seu excesso pode ser tóxico para humanos, animais e plantas. O intervalo de concentrações em que pode ser usado é estreito e depende da espécie.
É usado como catalisador em reações químicas e como solventes dessecante. Permite melhorar a resistência e flexibilidade de alguns polímeros.
Quantidades excessivas desse composto podem ser prejudiciais aos solos, pois é tóxico para microorganismos que são benéficos para as plantas.
[TOC]
Estrutura
O sulfato de cobre é formado por um íon de cobre (Cu2+) e um íon sulfato (então42-).
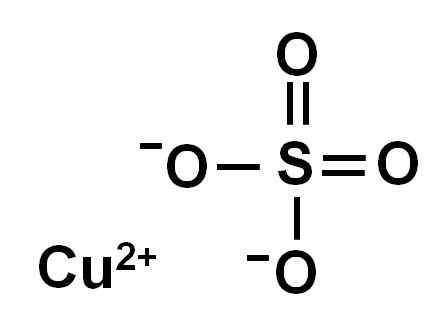 Ionica Sulfato de cobre (II). Autor: Marilú Stea.
Ionica Sulfato de cobre (II). Autor: Marilú Stea. Devido à perda de dois elétrons, o íon de cobre (II) tem a seguinte conformação eletrônica:
1s2 2s2 2 p6 3s2 3p6 3d9
Pode -se ver que o orbital tem 3d incompleto (tem 9 elétrons em vez de 10).
Nomenclatura
- Sulfato de cobre anidro
- Sulfato de cobre (II)
- Sulfato cúprico
Propriedades
Estado físico
Branco esverdeado sólido ou em forma de cristal.
Peso molecular
159,61 g/mol
Ponto de fusão
A 560 ºC, ele quebra.
Densidade
3,60 g/cm3
Solubilidade
22 g/100 g de água a 25 ° C. Insolúvel em etanol.
Propriedades quimicas
Quando é submetido à umidade do ar abaixo de 30 ° C, torna -se o composto de penta -hidrato Cuso4 •5h2QUALQUER.
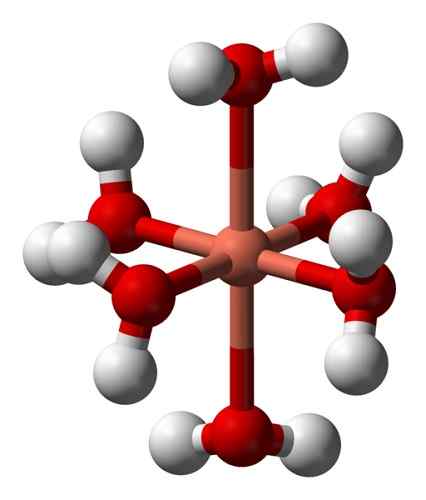
Suas soluções aquosas são azuis devido à formação do íon hexaacuocobre (II) [Cu (H (H2QUALQUER)6]2+ que produz essa coloração. Neste íon, duas das moléculas de água estão mais longe do átomo metálico do que os outros quatro.
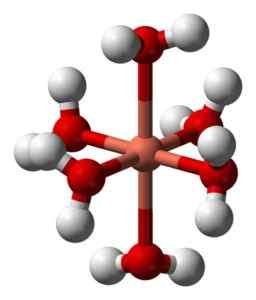 Estrutura deformada do íon hexaacuocobre (II) [Cu (H2QUALQUER)6]2+. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons.
Estrutura deformada do íon hexaacuocobre (II) [Cu (H2QUALQUER)6]2+. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons. Isso se deve ao chamado efeito Jahn-Teller, que prevê que esse tipo de sistema experimenta a distorção causada pelo fato de que o Cu2+ Tem uma estrutura eletrônica que termina em D9, isto é, um orbital incompleto (seria completo se fosse D10).
Pode atendê -lo: hidróxido de cálcio (CA (OH) 2): estrutura, propriedades, obtenção, usoSe a amônia for adicionada (NH3) Essas soluções são formadas em que o NH3 As moléculas de água estão deslocando sucessivamente. Eles são formados, por exemplo, de [Cu (NH3) (H2QUALQUER)5]2+ Até [Cu (NH3)4(H2QUALQUER)2]2+.
Quando o Cuso4 É aquecido à sua decomposição emite gases tóxicos e se torna óxido cúprico.
Obtenção
O sulfato de cobre anidro pode ser obtido por desidratação total do composto pentahidrato, que é alcançado aquecendo -o até que as moléculas de água evaporem.
CUSO4 •5h2O + calor → CuO4 + 5 h2Ou ↑
O composto penta -hidrato é azul, então a água CUSO é obtida ao perder a água da cristalização4 Anidro branco.
Formulários
Alguns de seus usos se sobrepõem ao do composto penta -hidrato. Outros são específicos para a substância anidra.
Como agente antibacteriano
Tem potencial como agente antimicrobiano. Ele tem sido usado há milhares de anos, mesmo em culturas da América do Sul e América Central, para evitar a infecção por feridas através da gaze impregnada em uma solução deste composto.
Estima -se que no mecanismo de sua atividade antibacteriana os íons cu2+ Eles formam quelatos com enzimas que são cruciais para as funções celulares de bactérias, desativando -as. Eles também induzem a formação de radicais hidroxila OH •, que danificam as membranas de bactérias e seu DNA.
 O cuso4 Pode funcionar contra algumas bactérias patogênicas. Autor: Gerd Altmann. Fonte: Pixabay.
O cuso4 Pode funcionar contra algumas bactérias patogênicas. Autor: Gerd Altmann. Fonte: Pixabay. Recentemente, foi relatado que Cuso Traces4 Eles podem aumentar a atividade antimicrobiana de produtos naturais ricos em polifenóis, como extratos de granada e infusões de alguns tipos de plantas de chá.
Em aplicações veterinárias
É usado como anti -séptico e adstringente para membranas mucosas e para tratar a conjuntivite e otite externas. Serve para realizar banhos terapêuticos ou profiláticos para evitar podridão de gado, ovelha e outros mamíferos.
 Soluções aquosas de Cuo4 Eles servem para curar os buracos de gado. Autores: Ingrid und Stefan Melichar. Fonte: Pixabay.
Soluções aquosas de Cuo4 Eles servem para curar os buracos de gado. Autores: Ingrid und Stefan Melichar. Fonte: Pixabay. Serve como um agente cáustico para massas necróticas nas extremidades do gado, úlceras em estomatite e tecido granulado destes. Ele usou como fungicida no tratamento de corante e doenças causadas por fungos da pele.
Também é usado como um emético (agente para provocar vômito) em porcos, cães e gatos; como adstringente antidiarréico para bezerros e controlar a monilíase intestinal em aves e peru tricomoníase.
Como um suplemento de alimentação animal
O sulfato de cobre tem sido usado como suplemento em quantidades muito pequenas para alimentar gado, porcos e aves. Serve para tratar a deficiência de cobre em ruminantes. No caso de porcos e pássaros, é usado como estimulante de crescimento.
Pode atendê -lo: cromatogramaO cobre foi identificado como essencial para a biossíntese de hemoglobina em mamíferos, estrutura cardiovascular, síntese do colágeno ósseo, sistemas enzimáticos e reprodução.
Como mencionado na seção anterior, ele também pode ser fornecido como medicamento para controle de doenças. No entanto, os níveis de suplementação e/ou medicação devem ser monitorados com cuidado.
 As aves currais e seus ovos podem ser afetadas por um excesso de sulfato de cobre em sua dieta. Autor: Pexels. Fonte: Pixabay.
As aves currais e seus ovos podem ser afetadas por um excesso de sulfato de cobre em sua dieta. Autor: Pexels. Fonte: Pixabay. De uma certa quantidade, que depende de cada espécie, pode uma diminuição no crescimento, perda de apetite e peso, danos a certos órgãos e até a morte de animais podem ocorrer.
Por exemplo, em galinhas, a suplementação de 0,2% ou mais diminui a ingestão de alimentos destes com a conseqüente perda de peso, diminuição da produção de ovos e a espessura de suas peels.
Em aplicações agrícolas
Em sistemas de produção orgânicos, não é permitido usar fungicidas sintéticos, apenas os produtos de cobre e enxofre são aceitos, como sulfato de cobre.
Por exemplo, certos fungos que atacam plantas de maçã, como Venturia inaequalis, são eliminados com este complexo. Pensa -se que possivelmente os íons cu2+ Eles são capazes de entrar no esporo de fungos, desnaturalizar proteínas e bloquear várias enzimas.
 O sulfato de cobre serve para combater alguns fungos que atacam maçãs. Algardas em Lt.Wikipedia / domínio público. Fonte: Wikimedia Commons.
O sulfato de cobre serve para combater alguns fungos que atacam maçãs. Algardas em Lt.Wikipedia / domínio público. Fonte: Wikimedia Commons. Importância do cobre nas plantas
O elemento de cobre é importante em processos fisiológicos de plantas como fotossíntese, respiração e defesa contra antioxidantes. Tanto a deficiência desse elemento quanto seu excesso geram espécies oxigenadas reativas que são prejudiciais às moléculas e estruturas destes.
O intervalo de concentrações de cobre para o crescimento ideal e o desenvolvimento de plantas é muito estreito.
Efeitos adversos na agricultura
Quando este produto é excessivamente usado em atividades agrícolas, pode ser fitotóxico, causar desenvolvimento prematuro de frutas e mudar sua cor.
Além disso, o cobre se acumula no solo e é tóxico para microorganismos e minhocas. Isso conflita o conceito de agricultura orgânica.
 Embora o cuso4 É usado na agricultura orgânica pode ser prejudicial aos vermes da terra. Autor: Patricia Maine Degrave. Fonte: Pixabay.
Embora o cuso4 É usado na agricultura orgânica pode ser prejudicial aos vermes da terra. Autor: Patricia Maine Degrave. Fonte: Pixabay. Em reações químicas
O cuso4 O anidro serve como um catalisador para várias reações de compostos orgânicos carbonil com dióis ou seus epóxidos, formando dioxolanos ou acetonídeos. Graças a este composto, as reações podem ser feitas em condições suaves.
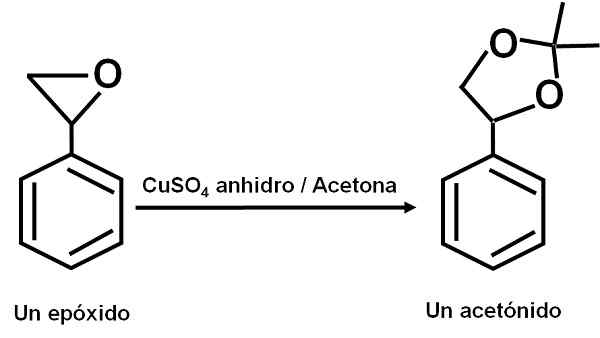 Exemplo de reação em que o cuso4 ANYDROUS age como um catalisador. Autor: Marilú Stea.
Exemplo de reação em que o cuso4 ANYDROUS age como um catalisador. Autor: Marilú Stea. Também foi relatado que sua ação catalítica permite desidratar álcoois secundários, terciários, benzil e alilicos às suas olefinas correspondentes. A reação é feita de uma maneira muito simples.
Pode atendê -lo: AnetolO álcool puro é aquecido junto com o cuso4 anidro a uma temperatura de 100-160 ° C por um tempo de 0,5-1,5 horas. Assim, ocorre desidratação de álcool e olefina, destilos puros da mistura de reação.
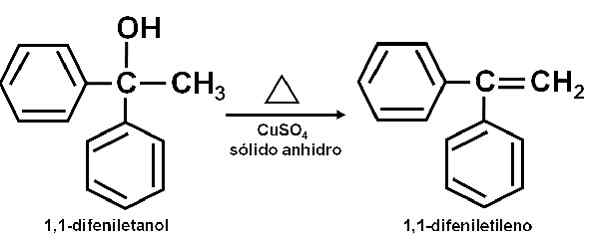 Desidratação de um álcool para sulfato de cobre (ii) anidro. Autor: Marilú Stea.
Desidratação de um álcool para sulfato de cobre (ii) anidro. Autor: Marilú Stea. Como um agente desidratante
Este composto é usado em laboratórios de química como dessecante. Serve para desidratar fluidos orgânicos como solventes. Absorver água formando o composto de penta -hidrato de Cuo4 •5h2QUALQUER.
 Quando o Cuso4 Anhidro branco absorve a água se torna o composto de pentahidrato azul4.5h2QUALQUER. Crystal Titan/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Quando o Cuso4 Anhidro branco absorve a água se torna o composto de pentahidrato azul4.5h2QUALQUER. Crystal Titan/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Para melhorar os polímeros
O cuso4 Anhdro tem sido usado para melhorar as propriedades de certos polímeros e, ao mesmo tempo, permitem que eles sejam recicláveis.
Por exemplo, partículas do composto de acetona foram misturadas com borracha de acrilonitrila-butadieno em um moinho especial, tentando fazer partículas de cuso4 Seja muito pequeno.
O sulfato de cobre melhora os pontos da união do polímero, formando uma mistura com alta resistência, dureza e flexibilidade surpreendente.
Em aplicações terapêuticas descontinuadas
No passado, soluções de sulfato de cobre para lavagem gástrica eram usadas quando alguém sofreu um envenenamento por fósforo branco. No entanto, a solução se agitou prontamente para evitar envenenamento por cobre.
As soluções deste composto também foram usadas juntamente com outras substâncias para queimaduras tópicas na pele por fósforo.
Às vezes eles serviram em certas formas de nutrição.
Certas loções para eczema, impetigo e intertrigo continham cuo4. As soluções foram usadas como um adstringente em infecções oculares. Às vezes, os cristais eram aplicados diretamente em queimaduras ou úlceras.
Todas essas aplicações não são mais feitas devido à toxicidade que pode induzir excesso de composto.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Sulfato de cobre. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Montag, J. et al. (2006). Um estudo in vitro sobre Venturia inaequalis. J. Agric. Food Chem. 2006, 54, 893-899. Link recuperado.Springer.com.
- Holloway, a.C. et al. (2011). Aprimoramento de atividades antimicrobianas de chá branco inteiro e sub-fracionado por dependência de sulfato de cobre (ii) e vitamina C contra Staphylococcus aureus; Para abordagem mecanicista. BMC complemento Altern Med 11, 115 (2011). Recuperado do BMCCompleMpleMedTherapies.BiomedCentral.com.
- Sanz, a. et al. (2018). Mecanismo de captação de cobre de Arabidopsis da Tália Transportadores de copt de alta efinidade. Protoplasma 256, 161-170 (2019). Link recuperado.Springer.com.
- Griminger, p. (1977). Efeito do sulfato de cobre na produção de ovos e espessura da concha. Poultry Science 56: 359-351, 1977. Recuperado do acadêmico.OUP.com.
- Hanzlik, r.P. E Leinwetter, M. (1978). Reação de epóxidos e compostos de carbonil catalisados por sulfato de cobre anidro. J. Org. Chem., Vol.43, não.3, 1978. Recuperado de bares.ACS.org.
- Okonkwo, a.C. et al. (1979). Requisito de cobre de porcos bebês alimentados com dieta purificada. The Journal of Nutrition, volume 109, edição 6, junho de 1979, páginas 939-948. Recuperado do acadêmico.OUP.com.
- Hoffman, r.V. et al. (1979). Sulfato de cobre anidro (II): um eficácia. J. Org. Chem., 1980, 45, 917-919. Recuperado de bares.ACS.org.
- Shao, c. et al. (2018). Resistência à tração aprimorada de compósitos de borracha de acrilonitrila-butadieno/sulfato de cobre anidro preparado por reticulação de coordenação. Polim. Touro. 76, 1435-1452 (2019). Link recuperado.Springer.com.
- Betts, j.C. et al. (2018). Novos antibacterianos: alternativas aos antibióticos tradicionais. Cobre. Em avanços na fisiologia microbiana. Recuperado de cientedirect.com
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Sites do Google. Faça sulfato de cobre anidro. Na química doméstica do paradoxo. Recuperado de sites.Google.com.

