Conceito de sublimação, processo e exemplos
- 2652
- 214
- Alfred Kub
O sublimação É um processo termodinâmico no qual uma mudança de estado endotérmico ocorre diretamente de um sólido para um gás, sem a formação prévia do líquido. Um excelente exemplo desse processo é o de gelo seco; Quando exposto ao sol ou imerso em um líquido, ele passa diretamente do estado sólido para o gasoso.
O comportamento do sólido em condições normais é aquecer e originar uma primeira gota, onde mais partículas sólidas se dissolvem até derreter completamente. Enquanto isso, na sublimação, fala -se de uma "bolha", de um vapor progressivo sem molhar a superfície que toca, mas imediatamente depositada ou cristaliza.
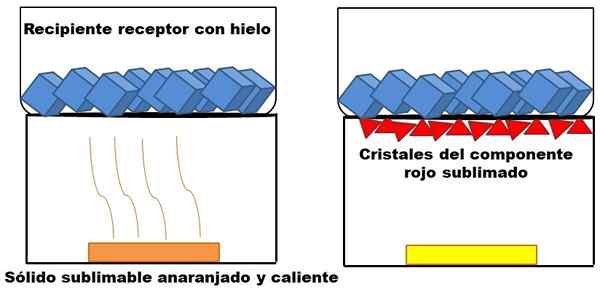
 Exemplo de sublimação de um sólido hipotético de laranja. Fonte: Gabriel Bolívar.
Exemplo de sublimação de um sólido hipotético de laranja. Fonte: Gabriel Bolívar. O que é descrito no parágrafo superior é representado na imagem superior. Suponha que uma mistura sólida laranja (à esquerda), que comece a aumentar sua energia, aumentando a temperatura. O componente vermelho sublimal e depois depositado na parte inferior do recipiente receptor, cuja temperatura é menor devido a cubos de gelo em seu conteúdo.
Triângulos ou cristais vermelhos são depositados graças à superfície fria deste recipiente (à direita), que absorve sua temperatura; E mesmo que não seja mostrado, o tamanho de seus cubos de gelo deve diminuir devido à absorção de calor. O sólido restante possui um componente amarelo não publicável em condições de processo.
[TOC]
Conceito de sublimação
Processo
Já foi dito que a sublimação é uma mudança de estado endotérmico, porque para isso, deve haver absorção de calor. Se o sólido absorve o calor, sua energia aumentará, portanto suas partículas também vibrarão em maiores frequências.
Quando essas vibrações se tornam muito fortes, elas acabam afetando as interações intermoleculares (não ligações covalentes); E, consequentemente, mais cedo ou mais tarde as partículas levarão mais distâncias uma da outra, até que elas conseguem fluir e se mover mais livremente pelas regiões do espaço.
Pode atendê -lo: regra diagonalEm alguns sólidos, as vibrações são tão fortes que algumas partículas são "acionadas" fora da estrutura, em vez de aglomeradas em aglomerados móveis que definem uma gota. Essas partículas escapam e integram a primeira "bolha", que prefere formar os primeiros vapores do sólido sublimado.
É então falado não sobre um ponto de fusão, mas de uma sublimação. Enquanto ambos dependem da pressão reinante do sólido, o ponto de sublimação é mais; Portanto, sua temperatura varia acentuadamente com as mudanças de pressão (como é o caso do ponto de ebulição).
Da estrutura sólida ao transtorno de gás
Na sublimação, também é dito que há um aumento na entropia do sistema. Os estados energéticos das partículas passam por serem limitados por suas posições fixas na estrutura sólida, para homogeneizar em suas direções caprichosas e caóticas no estado gasoso, mais uniforme, onde finalmente adquirem uma energia cinética média.
Diagrama de fases e ponto triplo
O ponto de sublimação depende da pressão; Porque, caso contrário, as partículas sólidas absorveriam o calor para não ser demitido para o espaço fora do sólido, mas para formar gotas. Não seria sublimado, mas derreteria ou derreteria, como é o mais comum.
Quanto maior a pressão externa, menor a probabilidade de sublimação, uma vez que o sólido a derreter for obrigado.
Mas quais sólidos são sublimíveis e que não? A resposta está em seus diagramas P vs Thases, como mostrado abaixo:
Pode atendê -lo: neon: história, propriedades, estrutura, riscos, usos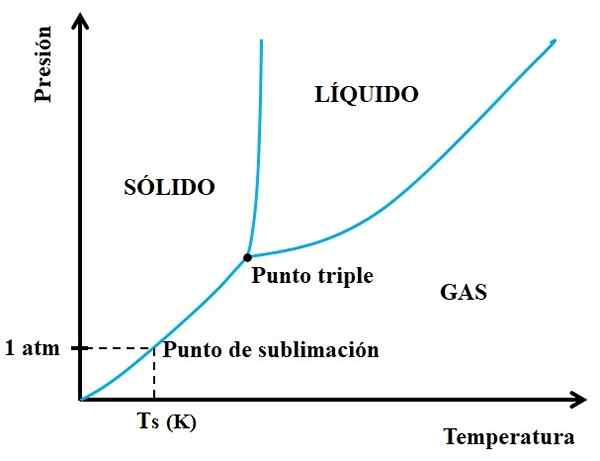 Diagrama de fases para uma substância hipotética. Fonte: Gabriel Bolívar.
Diagrama de fases para uma substância hipotética. Fonte: Gabriel Bolívar. Você precisa olhar primeiro para o ponto triplo e viajar pelo trecho mais baixo: aquele que separa os estados sólidos e gasosos. Observe que na região sólida, deve haver uma diminuição na pressão para que a sublimação ocorra (não necessariamente 1 pressão atmosférica). Um atm 1 atm, a substância hipotética sublim será a uma temperatura TS expressa em k.
Quanto mais longo e mais longo a seção ou a curva sob o ponto triplo, maior a capacidade do sólido de sublimbar a diferentes temperaturas; Mas se estiver bem abaixo de 1 atm, será necessário com altas lacunas para obter sublimação, para que as pressões sejam reduzidas (0,0001 atm, por exemplo).
Condições
Se o ponto triplo for milhares de vezes menor que a pressão atmosférica, o sólido nunca sublimá ou mesmo aplicará ultra vida (sem mencionar sua suscetibilidade a decompor pela ação do calor).
Se não for esse o caso, as sublimações são feitas por meio de moderadamente e enviando o sólido a ascensão, para que suas partículas escapem mais facilmente, sem a necessidade de absorver tanto calor.
A sublimação se torna muito importante quando são especialmente sólidos com alta pressão de vapor; isto é, a pressão dentro, reflexão da eficiência de suas interações. Quanto maior sua pressão de vapor, mais odoramente é e também mais sublimável.
Exemplos
Purificação sólida
A imagem do sólido laranja e seu componente avermelhado sublimável é um exemplo do que a sublimação representa em relação à purificação sólida. Os triângulos vermelhos podem ser reabastecidos quantas vezes forem necessárias até que a alta pureza seja garantida.
Pode atendê -lo: espátula de laboratórioEsta técnica é usada principalmente com sólidos perfumados. Por exemplo: cânfora, cafeína, benzoina e mentol.
Entre outros sólidos que podem sublinhar sublimação que temos: iodo, gelo (em grandes altitudes), teobromina (chocolate), sacarina, morfina e outras drogas, bases de nitrogênio e antraceno.
Síntese cristalina
Voltando aos triângulos vermelhos, a sublimação oferece uma alternativa à cristalização convencional; Os cristais não serão mais sintetizados a partir de uma solução, mas por meio.
Digamos que, se eles tiverem quadrados vermelhos, o crescimento dos cristais manterá essa geometria e não deve se tornar triangular. Os quadrados vermelhos crescerão gradualmente à medida que a sublimação ocorre. No entanto, é um complexo operacional e molecularmente complexo, no qual muitas variáveis envolvidas são vistas.
Exemplos de cristais sintetizados por sublimação são: carboneto de silício (sic), grafite, arsênico, selênio, fósforo, nitruro de alumínio (ALN), sulfeto de cádmio (CDS), seleniuro de zinco (Znsse), iodeto de mercúrio (HGI)2), grafeno, entre outros.
Observe que eles são realmente dois fenômenos compensados: sublimação progressiva e deposição (ou sublimação reversa); O vapor emigra das regiões ou superfícies mais frias, para finalmente depositar na forma de cristais.
Assuntos de interesse
Exemplos de sublimação.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2019). Sublimação (transição de fase). Recuperado de: em.Wikipedia.org
- Jones, Andrew Zimmerman. (27 de janeiro de 2019). Sublimação. Recuperado de: pensamento.com
- Sheila Morrissey. (2019). O que é sublimação na química? - Definição, processo e exames. Estudar. Recuperado de: estudo.com
- Elsevier b.V. (2019). Método de sublimação. Cientedirect. Recuperado de: ScientEdirect.com
- « Características do Subcaducifolio da Floresta Tropical, Flora, Fauna
- Propriedades integrais integrais, aplicações, cálculo (exemplos) »

