Soluções de amortecedor

- 2022
- 244
- Gilbert Franecki
Explicamos quais são as soluções de amortecimento, suas propriedades, componentes, tipos e damos vários exemplos
 As soluções de absorção de choque regulam o pH em torno de um valor específico
As soluções de absorção de choque regulam o pH em torno de um valor específico O que são soluções de amortecimento?
As soluções de amortecedor, Também chamados de tampões, pH ou reguladores de tampões, são soluções aquosas formadas por ácido fraco e sua base conjugada ou uma base fraca e seu ácido conjugado.
Eles são chamados de soluções de amortecedor, pois têm a capacidade de amortecer a mudança de pH após a adição de ácidos ou bases em pequenas quantidades, mesmo que sejam ácidos ou bases fortes.
As soluções de amortecedor são muito úteis, pois permitem que o pH seja constante. Existem muitas reações químicas que precisam de um pH específico e constante para funcionar bem.
Propriedades das soluções musoriais
São soluções aquosas
Tanto o conceito de pH quanto a escala de pH só fazem sentido em soluções aquosas, para que todos os buffers ou soluções de amortecimento sejam preparados em água.
Sua operação é baseada no equilíbrio ácido-base e nos princípios de Le Chatlier
Os tampões são baseados em reações de dissociação de ácido/base reversíveis que estão em equilíbrio. Ao adicionar ácidos ou bases fortes ao meio ambiente, esse equilíbrio é perturbado, de modo que o sistema reage para neutralizar a perturbação, seguindo os princípios de Le Catelier. É assim que os buffers conseguem amortecer as grandes mudanças no pH.
Seu pH é facilmente calculado com a equação de Henderson-Haselbalch
Independentemente de que tipo de solução de amortecedor, seu pH antes e depois de adicionar pequenas quantidades de ácidos ou bases fortes, ele pode ser calculado por meio da equação de Henderson-Hohaselbalch:
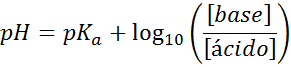
Onde [base] refere -se à concentração molar da base (ou ao sal da base do conjugado) e [ácido] refere -se à concentração molar do ácido (ou do sal do ácido conjugado).
Pode atendê -lo: materiais elásticosEles são capazes de neutralizar parcialmente os ácidos e as bases
As soluções de amortecimento são compostas por uma substância básica e uma substância ácida, que pode neutralizar bases e ácidos, respectivamente. Por esse motivo, eles podem amortecer o pH após a adição de ácidos fortes e bases fortes.
Sua operação depende da temperatura
O pH de uma solução tampão depende da acidez ou constante básica do ácido ou base fraca que ele contém. Essa constante depende da temperatura; portanto, a operação dessas soluções também depende da temperatura.
Quanto mais concentrado, maior sua capacidade de amortecer ou regular o pH
A capacidade de amortecimento depende da concentração total da solução é maior que a concentração final do ácido ou base forte que é adicionada. Por esse motivo, quanto maior a concentração total da solução tampão, maior sua capacidade de amortecer ácidos ou bases fortes.
Componentes de uma solução de amortecimento ou buffer
Quimicamente, as soluções de amortecimento são formadas por apenas dois componentes. Esses componentes podem ser um ácido fraco misturado com um sal de sua base conjugada ou uma base fraca misturada com um sal de seu ácido conjugado.
Existem duas maneiras diferentes de obter esses componentes na mesma solução, como veremos abaixo:
1. Preparação de buffers misturando soluções de seus componentes
Esta é a maneira mais direta de preparar uma solução buffer. Para fazer isso, soluções separadas de ácido fraco (por exemplo, ácido acético) e um sal base conjugado (por exemplo, acetato de sódio) são soluções separadas) são preparadas). Em seguida, ambas as soluções estão se misturando gradualmente até o pH desejado.
Pode servir a você: Ion amônio (NH4+): fórmula, propriedades e usos
- As soluções são misturadas pouco a pouco até o pH desejado
2. Preparação de buffers por neutralização parcial de uma solução de um ácido fraco
Nesse caso, uma solução ácida fraca é preparada com a concentração total desejada e, em seguida, o hidróxido de sódio ou potássio é adicionado pouco a pouco até atingir o pH desejado.
Tipos de soluções de buffer
As soluções de amortecedor podem ser classificadas de acordo com os tipos de componentes que possuem ou de acordo com seu pH final.
De acordo com os tipos de componentes:
- Buffer de base fraco e conjugado: Nesses casos, o pH depende de PKpara de ácido fraco.
- Buffer de base fraco e ácido conjugado: Nesses casos, o pH depende de PKb fraco.
- Tampão de sais de ácido polipótico: Em alguns casos, tanto o papel do ácido fraco quanto sua base conjugada são os sais da neutralização parcial de um ácido que possui vários prótons, como ácido sulfúrico ou fosfórico.
De acordo com seu pH final:
Dependendo da acidez ou constante básica, uma solução de buffer pode regular o pH em torno de diferentes faixas de pH, dando origem a três tipos de buffers:
- Buffers de ácido: São aqueles que regulam o pH em torno dos valores inferiores a 7. Eles são preparados com ácidos fracos cujo PKpara ser menor que 7 ou com bases fracas cujo PKb ser maior que 7.
- Buffers neutros: São aqueles que regulam o pH em torno de 7. Eles geralmente são compostos de ácidos fracos ou bases que têm um PKpara ou um pkb perto de 7.
- Buffers alcalinos: São aqueles que regulam o pH em torno de valores maiores que 7. Eles são preparados com ácidos fracos cujo PKpara ser maior que 7 ou com bases fracas cujo PKb é menor que 7.
Exemplos de buffers ou soluções de amortecimento
Tampão de ácido acético/acetato de sódio
Este é um tampão de um ácido fraco (ácido acético) e um sal de sua base conjugada (acetato de sódio). O equilíbrio envolvido e sua constante de equilíbrio são:
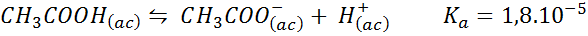
Este buffer regula o pH em torno 4.74.
Buffer de amônia/cloreto de amônio
Este é um tampão de base fraco (amônia ou hidróxido de amônio) e um sal de seu ácido conjugado (cloreto de amônio). O equilíbrio envolvido e sua constante de equilíbrio são:
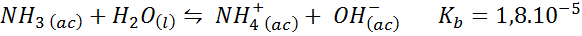
Este é um tampão alcalino que regula o pH ao redor 9.26.
Tampão bissulfato/sulfato
Nesse caso, o íon bissulfato toca o papel de ácido fraco cuja base conjugada é o íon sulfato. O equilíbrio envolvido é:
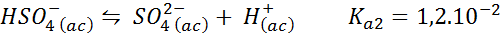
Esta é uma solução damadora de ácido que regula o pH em torno 3.05.
Buffer de ácido carbônico/bicarbonato
Este é um dos sistemas de regulação de pH mais importantes em nosso sangue. A reação envolvida é: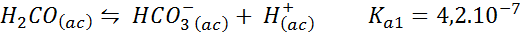
Este buffer regula o pH em torno 6.38.
Fosfato de tampão de di -hidrogênio/fosfato de hidrogênio
Este é um dos sistemas de regulação de pH mais usados em biologia e bioquímica, pois permite regular o pH muito próximo ao pH fisiológico ao qual a maioria das reações químicas nas células ocorrem. A reação é:
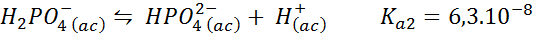
Este buffer regula o pH em torno 7.20.

