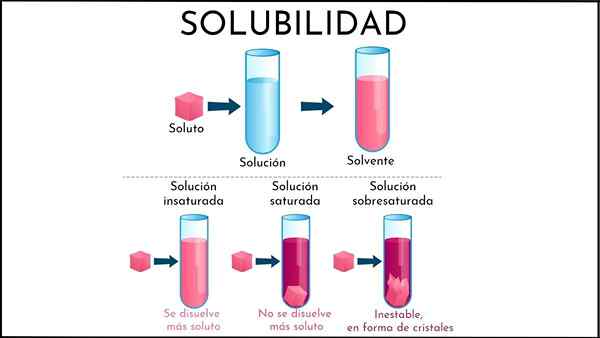
Solução insaturada
- 2673
- 92
- Ralph Kohler
 Na solução insaturada, a metade do solvente ainda é capaz de dissolver mais soluto
Na solução insaturada, a metade do solvente ainda é capaz de dissolver mais soluto O que é uma solução insaturada?
A solução insaturada É toda aquela solução em que o meio de solvente ainda é capaz de dissolver mais soluto. Este meio é geralmente líquido, embora também possa ser gasoso. Em relação ao soluto, é um conglomerado de partículas sólidas ou gasosas.
E quanto a solutos líquidos? Nesse caso, a solução é homogênea enquanto ambos os líquidos forem miscíveis. Um exemplo disso é a adição de álcool etílico à água; Os dois líquidos com suas moléculas, CHO3CH2Oh e h2Ou, eles são miscíveis porque formam pontes de hidrogênio (escolha3CH2OH OH2).
No entanto, se mixagens de diclorometano (escolha2Cl2) e água, eles formariam uma solução com duas fases: uma aquosa e a outra orgânica. Isso ocorre porque Chóis de CH2Cl2 e h2Ou interagir muito fracamente, então alguns deslizam sobre os outros, resultando em dois líquidos imiscíveis.
Uma queda mínima de CHO2Cl2 (soluto) o suficiente para saturar a água (solvente). Se, pelo contrário, eles pudessem formar uma solução insaturada, uma solução completamente homogênea seria vista.
Por esse motivo, apenas solutos sólidos e gasosos podem gerar soluções insaturadas.
O que é uma solução insaturada?
Em uma solução insaturada, as moléculas de solvente interagem com a eficácia, de modo que as moléculas de soluto não possam formar outra fase.
Isso significa que as interações solventes de solvente excedem, dadas as condições de pressão e temperatura, interações soluto-soluto.
Uma vez que as interações soluto-soluto aumentam, elas "orquestram" a formação de uma segunda fase. Por exemplo, se o meio de solvente for um líquido e o soluto é um sólido, o segundo se dissolverá no primeiro a formar uma solução homogênea, até que uma fase sólida apareça, o que nada mais é do que o soluto precipitado.
Pode atendê -lo: polimetilmetacrilatoEsse precipitado se deve ao fato de que as moléculas de soluto conseguem ser agrupadas por sua natureza química, intrínseca à sua estrutura ou links. Quando isso acontece, diz -se que a solução está saturada com soluto.
Portanto, uma solução de soluto insaturada consiste em uma fase líquida sem precipitar. Embora se o soluto seja gasoso, uma solução insaturada deve estar livre da presença de bolhas (que nada mais são do que aglomerados de refrigerantes).
Efeito de temperatura
A temperatura influencia diretamente o grau de insaturação de uma solução em relação a um soluto.
Isso pode ser principalmente devido a dois motivos: o enfraquecimento de interações soluto-soluto devido ao efeito de calor e ao aumento de vibrações moleculares que ajudam a dispersar as moléculas de soluto.
Se um meio de solvente for considerado um espaço compacto em cujos orifícios as moléculas de soluto são alojadas, a temperatura aumenta as moléculas vibrarão aumentando o tamanho desses orifícios; De tal maneira que o soluto pode fazer o seu caminho em outras direções.
Sólidos insolúveis
No entanto, alguns solutos têm interações tão fortes, que as moléculas de solvente são quase capazes de separá -las.
Quando é assim, uma concentração mínima do referido soluto dissolvido é suficiente para que ele precipite e, em seguida, é um sólido insolúvel.
Sólidos insolúveis, formando uma segunda fase sólida que difere da fase líquida, gera poucas soluções insaturadas.
Por exemplo, se 1L do líquido A puder dissolver apenas 1g de B sem precipitar, então ao misturar 1L de A com 0.5 g de B gerarão uma solução insaturada.
Pode servir você: hidrocolóideDa mesma forma, um posto de concentrações variando entre 0 e 1g de B também forma soluções insaturadas. Mas após 1g, B precipitará. Quando isso ocorre, a solução passa de não ser saturada para saturada de B.
Se uma solução saturada com 1 for submetida ao aquecimento.5g de B, o calor ajudará a dissolução do precipitado. No entanto, se houver muito B precipitado, o calor não pode dissolvê -lo.
Nesse caso, um aumento de temperatura simplesmente evaporaria o solvente ou o líquido para.
Exemplos de solução insaturada
Os exemplos de soluções não saturadas são numerosas, pois dependem do solvente e do soluto. Por exemplo, para o mesmo líquido A e outros solutos C, D, E… Z, suas soluções serão insaturadas, desde que não precipitem ou formarão uma bolha (se forem solutos gasosos).
-O mar pode contribuir com dois exemplos. A água do mar é uma solução maciça de salvamento. Se você colocar para ferver um pouco dessa água, será notar que ela é insaturada na ausência de sal precipitado. No entanto, à medida que a água evapora, os íons dissolvidos começam a ser agrupados, deixando salgadinho preso ao pote.
-Outro exemplo é a dissolução do oxigênio na água do mar. A molécula de O2 Frank as profundezas do mar o suficiente para respirar fauna marinha, embora seja pouco solúvel.
Por esse motivo, é comum observar as bolhas de oxigênio emergindo à superfície; dos quais, algumas moléculas conseguem se dissolver.
Uma situação semelhante ocorre com a molécula de dióxido de carbono, CO2. Ao contrário de o2, O co2 É um pouco mais solúvel porque reage com água para formar ácido carbônico, h2Co3.
Pode atendê -lo: sistemas materiaisDiferença com solução saturada
Resumindo o recém -explicado, quais são as diferenças entre uma solução insaturada e saturada? Primeiro, o aspecto visual: uma solução insaturada consiste em uma única fase. Portanto, não deve haver presença de sólido (fase sólida) ou bolha (fase de refrigerante).
Além disso, as concentrações de soluto em uma solução insaturada podem variar até que um precipitado ou bolha seja formado. Enquanto em soluções bifásicas saturadas (líquido-sólido ou líquido), a concentração de soluto dissolvido é constante.
Porque? Como as partículas (moléculas ou íons) que compõem o precipitado, estabelecem um equilíbrio com aqueles que estão dissolvidos no solvente:
Partículas de partículas dissolvidas do precipitado
Moléculas de bolha Moléculas dissolvidas
Este cenário não é contemplado em soluções insaturadas. Ao tentar dissolver mais solutos em uma solução saturada, o equilíbrio se move para a esquerda; para a formação de mais precipitados ou bolhas.
Porque em soluções insaturadas, esse equilíbrio (saturação) ainda não foi estabelecido (saturação) pode "armazenar" mais sólidos ou gás.
Ao redor de uma alga no fundo do mar, há oxigênio dissolvido, mas quando as bolhas de oxigênio nascem de suas folhas, isso significa que a saturação do gás ocorre; Caso contrário, as bolhas não seriam observadas.
Referências
- Química Geral. material de ensino. Lima: Universidade Católica Pontificada do Peru. Recuperado de: Corinto.PUCP.Edu.educaçao Fisica
- Helmestine, Anne Marie, Ph.D. (2018). Definição de solução insaturada. Recuperado de: pensamento.com
- Tutorvista (s.F.). Solução insaturada. Retirado de: Química.Tutorvista.com
- Química Librettexts (s.F.). Tipos de saturação. Recuperado de: química.Librettexts.org
- Nadine James. (2018). Solução não saturada: Definição e Exemplo. Recuperado de: estudo.com

