Buteno

- 4394
- 771
- Lonnie MacGyver
 Estrutura química do buuteno
Estrutura química do buuteno Qual é o buteno?
Ele Buteno É o nome que recebe uma série de quatro isômeros com fórmula química C4H8. São alcenos ou olefinas, ou seja, eles têm uma ligação dupla C = C em sua estrutura. Além disso, eles são hidrocarbonetos, que podem ser encontrados em depósitos de óleo ou originados por rachaduras térmicas e obtenção de produtos de menor peso molecular.
Os quatro isômeros reagem com o calor liberando oxigênio e uma chama amarela. Eles também podem reagir com um amplo espectro de pequenas moléculas que são adicionadas ao seu vínculo duplo.
Mas quais são os isômeros do buteno? Na imagem superior, a estrutura com esferas brancas (hidrogênios) e preto (carbonos) é representada para o 1-buteno. O 1-buteno é o isômero mais simples do hidrocarboneto C4H8.
Observe que existem oito esferas brancas e quatro esferas pretas, que concordam com a fórmula química.
Os outros três isômeros são cis e trans 2-buteno e iso-buteno. Todos eles exibem propriedades químicas muito semelhantes, embora suas estruturas causem variações nas propriedades físicas (pontos de fusão e ebulição, densidades, etc.).
Além disso, seus espectros IR têm padrões semelhantes de bandas de absorção.
Coloquialmente, 1-buteno é nomeado como buteno, embora 1-buteno se refere apenas a um único isômero e não a um nome genérico. Esses quatro compostos orgânicos são gases, mas podem ser liquefeitos a altas pressões ou condens.
Eles são uma fonte de calor e energia, reagentes para a síntese de outros compostos orgânicos e, acima de tudo, necessários para a fabricação de borracha artificial após a síntese do butadieno.
Propriedades físicas e químicas de Buteno
Peso molecular
56.106 g/mol. Esse peso é o mesmo para todos os isômeros da Fórmula C4H8.
Aspectos físicos
É um gás incolor e inflamável (como os outros isômeros) e tem um cheiro relativamente aromático.
Ponto de ebulição
Os pontos de ebulição para os isômeros de buteno são os seguintes:
1 -Buteno: -6º C
Cis-2-buteno: 3.7º c
Trans-2-buteno: 0.96º c
2 -Metilpropeno: -6.9º c
Ponto de fusão
1 -Buteno: -185.3º c
Cis-2-butene: -138.9º c
Trans-2-buteno: -105.5º c
2 -Metilpropeno: -140.4º c
Solubilidade
Buteno é muito insolúvel em água devido à sua natureza apolar. No entanto, se dissolve perfeitamente em alguns álcoois, como benzeno, tolueno e éteres.
Densidade
0.577 a 25º C. Portanto, é menos denso que a água e em um recipiente estaria localizado acima do mesmo.
Reatividade
Como qualquer alceno, sua ligação dupla é suscetível a adicionar moléculas ou oxidação. Isso faz do buteno e seus isômeros reativos. Por outro lado, são substâncias inflamáveis; portanto, antes de um excesso de temperatura, eles reagem com o oxigênio do ar.
Pode atendê -lo: butanal: estrutura, propriedades, usos e riscosEstrutura química do buuteno
Na imagem superior, a estrutura do 1-buteno é representada. À sua esquerda, você pode ver a localização da ligação dupla entre o primeiro e o segundo carbono.
A molécula tem uma estrutura linear, embora a região ao redor do link C = C seja plana devido à hibridação SP2 desses carbonos.
Se a molécula de 1-buteno fosse girada em um ângulo de 180º, a mesma molécula não teria mudanças aparentes; portanto, falta atividade óptica.
Como suas moléculas interagem? Os links C-H, C e C-C são a natureza apolar, então nenhum deles colabora na formação de um momento dipolar.
Consequentemente, moléculas CHO2= Chch2CH3 Eles devem interagir através das forças de dispersão de Londres.
A extremidade direita do buteno forma dipolo instantâneo, que a uma curta distância polariza os átomos adjacentes de uma molécula vizinha. Por outro lado, a extremidade esquerda do link c = c interage sobrepondo as nuvens π no topo do outro (como duas bolachas ou folhas).
Como existem quatro átomos de carbono que compõem o esqueleto molecular, suas interações dificilmente são suficientes para a fase líquida ter um ponto de ebulição de -6º C.
Isômeros constitucionais e geométricos
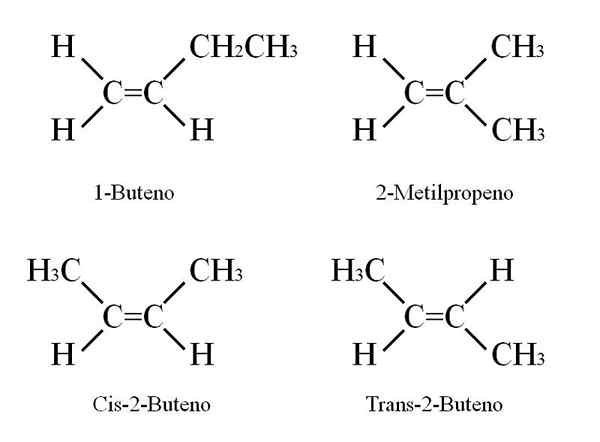 Estruturas butenosas. Fonte: Gabriel Bolívar
Estruturas butenosas. Fonte: Gabriel Bolívar O 1-buteno tem uma fórmula molecular C4H8; No entanto, outros compostos podem ter em sua estrutura a mesma proporção de átomos de C e H.
Como é possível? Se a estrutura do 1-buteno for observada cuidadosamente, os substituintes de carbonos C = C podem ser trocados. Esta troca produz outros compostos do mesmo esqueleto.
Além disso, a posição de ligação dupla entre C-1 e C-2 pode se mover em direção a C-2 e C-3: CH3Ch = chch3, 2-buteno.
No 2-buteno, os átomos H podem ser colocados no mesmo lado da ligação dupla, que corresponde ao estereoisômer cis; ou em uma orientação espacial oposta, no estereoisômer trans. Ambos constituem o que também é conhecido como isômeros geométricos. O mesmo se aplica a grupos -Ch3.
Da mesma forma, observe que, se deixado na molécula de Cho3Ch = chch3 Os átomos H de um lado e os grupos CH3 Em outro, seria obtido um isômero constitucional: CH2= C (CH3)2, 2-metilpropeno (também conhecido como iso-buteno).
Pode atendê -lo: nitrato de potássio (KNO3)Esses quatro compostos têm a mesma fórmula C4H8 Mas estruturas diferentes. 1-buteno e 2-metilpropeno são isômeros constitucionais; e cis e trans-2-buteno, isômeros geométricos entre eles dois (e constitucional em relação ao resto).
Estabilidade
Calor de combustão
Da imagem superior, qual dos quatro isômeros representa a estrutura mais estável? A resposta pode ser encontrada, por exemplo, nos aquecimentos de combustão de cada um deles.
Ao reagir com oxigênio, o isômero com a Fórmula C4H8 é transformado em CO2 liberando água e calor:
C4H8(g) + 6o2(g) => 4Co2(g) + 4h2O (G)
A combustão é exotérmica, então quanto mais calor é liberado, mais instável é hidrocarboneto. Portanto, o dos quatro isômeros que libera menos calor para queimar no ar, será o mais estável.
Os aquecimentos de combustão para os quatro isômeros são:
-1-buteno: 2717 KJ/mol
-Cis-2-buteno: 2710 kJ/mol
-Trans-2-buteno: 2707 kJ/mol
-2-metilpropeno: 2700 kJ/mol
Observe que o 2-metilpropeno é o isômero que emite menos calor. Enquanto 1-buteno é o que libera mais calor, que se traduz em maior instabilidade.
Efeito estérico e eletrônico
Essa diferença de estabilidade entre isômeros pode ser deduzida diretamente da estrutura química.
De acordo com os alcenos, aquele que possui mais substituintes r adquire maior estabilização de seu duplo vínculo. Assim, o 1-buteno é o mais instável, porque mal tem um substituinte (-ch2CH3); isto é, é monossustuido (rhc = Cho2).
Os isômeros cis e trans do 2-buteno diferem em energia devido à tensão de van der Wall originada pelo efeito estérico.
No isômero cis, os dois grupos CH3 No mesmo lado da ligação dupla, eles se repelem, enquanto no isômero trans, estes são suficientemente remotos um do outro.
Mas por que então o 2-metilpropeno é o isômero mais estável? Porque o efeito eletrônico intercede.
Nesse caso, embora seja um alceno dissolvido, os dois grupos CH3 Eles estão no mesmo carbono; em uma posição geminal sobre a outra.
Esses grupos estabilizam o carbono de ligação dupla, dando -lhe parte de sua nuvem eletrônica (pois é relativamente mais ácida por ter hibridação SP2).
Além disso, no 2-buteno, seus dois isômeros têm apenas 2º carbonos; Enquanto o 2-metilpropeno contém um terceiro carbono, de maior estabilidade eletrônica.
Pode atendê -lo: estrutura de materiais: conceito e exemplosForças intermoleculares
A estabilidade dos quatro isômeros segue uma ordem lógica, mas o mesmo não acontece com as forças intermoleculares. Se seus pontos de fusão e ebulição forem comparados, eles descobrirão que não obedecerão a mesma ordem.
Esperava-se que o trans-2-buteno apresentasse as maiores forças intermoleculares para ter maior contato superficial entre duas moléculas, ao contrário do CIS-2-buteno, cujo esqueleto desenha um C. No entanto, o CIS-2-buteno ferve a uma temperatura mais alta (3.7º c), que o isômero trans (0.96º c).
Os pontos de ebulição semelhantes para 1-buteno e 2-metilpropeno os esperariam porque são estruturalmente muito semelhantes. No entanto, no estado sólido, a diferença muda radicalmente. O 1 -buteno derrete para -185.3º C, enquanto o 2 -metilpropeno em -140.4º c.
Além disso, o isômero CIS-2-Buteno derrete para -138.9º C, a uma temperatura muito próxima de 2-metilpropeno, o que pode significar que, no sólido, eles têm um arranjo igualmente estável.
A partir desses dados, pode -se concluir que, apesar de conhecer as estruturas mais estáveis, eles não lançam luz suficiente no conhecimento de como as forças intermoleculares operam no líquido; E ainda mais, na fase sólida desses isômeros.
Butenus usa
-Butenianos, dado seu calor de combustão, podem ser simplesmente usados como fonte de calor ou combustível. Assim, seria de esperar que a chama de 1-buteno quente mais do que a dos outros isômeros.
-Eles podem ser usados como solventes orgânicos.
-Eles servem como aditivos para elevar o nível de octana da gasolina.
-Dentro da síntese orgânica, o 1-buteno participa da produção de outros compostos, como: óxido de butileno, 2-glutanol, succinimida e terbutilmecaptono (usado para dar a gás de cozinha seu cheiro característico).
Além disso, dos isômeros Butene, você pode obter Butadieno (Cho2= CH-CH = CH2), da qual a borracha artificial é sintetizada.
Além dessas síntese, a diversidade dos produtos dependerá de quais moléculas são adicionadas à ligação dupla.
Por exemplo, halogenetos alquil podem ser sintetizados se forem reagidos com halogênios; álcoois, se adicionarem água em um meio ácido; e terceiros-butleres se eles adicionarem álcoois de baixo peso molecular (como metanol).
Referências
- Francis a. Tortoisshell. Quimica Organica. Ácidos carboxílicos (sexta edição, página 863-866). Mc Graw Hill.
- Wikipedia (2018). Buteno. Tirado de: é.Wikipedia.org
- YPF (julho). Butenianos. [PDF]. Retirado de: YPF.com
- William Reusch (2013). Reações adicionais de alces. Recuperado de: 2.Química.MSU.Edu
- PubChem (2018). 1-buteno. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov

