Estrutura de sólidos amorfos, propriedades, exemplos

- 5031
- 526
- Gilbert Franecki
O sólidos amorfos Eles são aqueles que não têm uma estrutura de alcance de longo prazo. Eles são o oposto do que é conhecido por um sólido cristalino. Suas partículas estão associadas de maneira confusa, semelhante à dos líquidos, mas com força suficiente para coesão em uma estrutura sólida.
Esse caráter amorfo é mais comum do que se poderia pensar; É de fato, um dos estados possíveis que a matéria condensada pode adotar. Isso entende que qualquer composto capaz de solidificar e, portanto, cristalizar, também pode ser anexado de maneira desordenada se as condições experimentais permitirem.
 Algodão de açúcar é um exemplo de um amorfo sólido. Fonte: Pixabay.
Algodão de açúcar é um exemplo de um amorfo sólido. Fonte: Pixabay. O acima é geralmente aplicado a substâncias puras, sejam elementos ou compostos. Mas também é válido no caso de misturas. Muitas misturas sólidas são amorfas, como com algodão de açúcar, chocolate, maionese ou purê de batata.
O que um sólido é amorfo não o torna menos valioso do que um cristalino. O distúrbio estrutural às vezes oferece propriedades únicas que não exibiam em uma condição cristalina. Por exemplo, o silício amorfo é preferido na indústria fotovoltaica antes da lente para certas aplicações de pequena escala.
[TOC]
Estrutura de sólidos amorfos
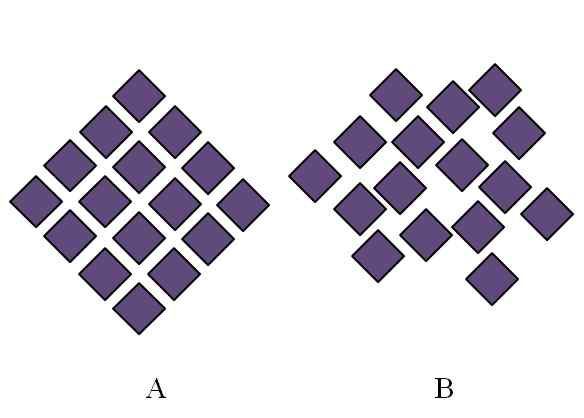 Diferença entre uma estrutura cristalina e uma estrutura amorfa. Fonte: Gabriel Bolívar.
Diferença entre uma estrutura cristalina e uma estrutura amorfa. Fonte: Gabriel Bolívar. A estrutura de um sólido amorfo é confuso; Falta periodicidade ou padrão estrutural. A imagem superior ilustra este ponto. Corresponde a um sólido cristalino, enquanto B representa um amorfo sólido. Observe que em B Rhombus roxos são organizados arbitrariamente, mesmo quando em e B existem o mesmo tipo de interação.
Pode atendê -lo: fenolftaleína (C20H14O4)Se B também for visto, será visto que existem espaços que parecem estar vazios; isto é, a estrutura apresenta defeitos ou irregularidades. Portanto, parte do distúrbio microscópico ou interno de um sólido amorfo se deve ao fato de que suas partículas "acomodam" de tal maneira que a estrutura resultante tem muitas imperfeições.
A princípio, o escopo foi feito no grau de ordenação de sólidos amorfos. Em B, dificilmente existem alguns rhombus que parecem alinhados em ordem. Pode haver regiões ordenadas; Mas apenas no curto alcance.
Dizem então que um sólido amorfo é feito de cristais incomensuráveis pequenos de estruturas diferentes. A soma de todas essas estruturas acaba labiríntica e sem sentido: a estrutura global se torna amorfa, composta por uma série de blocos cristalinos espalhados por toda parte.
Propriedades
As propriedades de um sólido amorfo variam dependendo da natureza de suas partículas conformadas. No entanto, existem certas características gerais que podem ser mencionadas. Os sólidos amorfos podem ser vítreo, quando têm aspectos semelhantes aos cristais; ou vice.
Sendo suas estruturas confusas, não geram espectros de difração de raio x confiável. Além disso, seus pontos de fusão não são precisos, mas cobrem um intervalo de valores.
Por exemplo, o ponto de fusão para um sólido amorfo pode variar de 20 a 60 ºC. Enquanto isso, os sólidos cristalinos derretem a uma temperatura específica, ou em um intervalo estreito, se contiverem muitas impurezas.
Outra característica dos sólidos amorfos é que, quando quebram ou fraturas, não causam rostos geométricos e planos, mas fragmentos irregulares com rostos curvos. Quando não são vítreo, são apresentados como corpos empoeirados e opacos.
Pode atendê -lo: Alilo: unidade allyic, carbocalização, radical, exemplosPreparação
Mais do que um sólido amorfo, é conveniente lidar com esse conceito como um 'estado amorfo'. Todos os compostos (iônicos, moleculares, poliméricos, metálicos, etc.) Eles são capazes, em certa medida, e se as condições experimentais permitirem, forme os sólidos amorfos e não cristalinos.
Por exemplo, na síntese orgânica compostos sólidos no início são obtidos como massas empoeiradas. Seu conteúdo de impurezas é tão alto que eles afetam sua ordem molecular de longa faixa. É por isso que quando o produto é recriado repetidamente, o sólido se torna cada vez mais cristalino; está perdendo seu caráter amorfo.
Isso não significa que os sólidos amorfos são necessariamente materiais impuros; Vários deles são amorfos por sua própria natureza química.
Uma substância pura pode solidificar amoricamente se o seu líquido esfriar bruscamente, para que suas partículas não cristalizem, mas adote uma configuração vítrea. O resfriamento é tão rápido que as partículas não têm tempo suficiente para acomodar os blocos cristalinos que mal "nascem".
A água, por exemplo, é capaz de existir em um estado vítreo, amorfo e não apenas como gelo.
Exemplos de sólidos amorfos
Minerais e plástico
 Obsidian é um dos poucos minerais amorfos que são conhecidos. Fonte: Pixabay.
Obsidian é um dos poucos minerais amorfos que são conhecidos. Fonte: Pixabay. Praticamente qualquer material cristalino pode se ajustar a uma forma amorfa (e vice -versa). Isso acontece com alguns minerais, que por razões geoquímicas não poderiam estabelecer formalmente seus cristais convencionais. Outros, por outro lado, não formam cristais, mas vidro; É o caso da obsidiana.
Por outro lado, os polímeros tendem a solidificar amorficamente, uma vez que suas moléculas são grandes demais para definir uma estrutura ordenada. Aqui estão resinas, borrachas, espuma de poliestireno (anime), plásticos, teflon, baquelita, entre outros.
Pode atendê -lo: ésteresTecido biológico
Os sólidos biológicos são principalmente amorfos, como: tecido de órgão, pele, cabelo, córnea, etc. Além disso, gordura e proteínas formam massas amorfas; No entanto, com a preparação adequada, eles podem cristalizar (cristais de DNA, proteínas, gorduras).
Vidro
 Vidro, um sólido amorfo
Vidro, um sólido amorfo Embora quase por último, o sólido amorfo mais representativo é, de longe, o próprio vidro. Sua composição em essência é a mesma do quartzo: sio2. Tanto o cristal de quartzo quanto o vidro são redes covalentes tridimensionais; Somente a rede de vidro é confusa, com links SI-OR de diferentes comprimentos.
 Amostra de vidro metálico
Amostra de vidro metálico O vidro é o sólido amorfo por excelência, e os materiais que adquirem uma aparência semelhante são considerados um estado vítreo.
Carbono e metais
Temos carbono amorfo, sendo o carbono ativado por um dos mais importantes para suas habilidades absorventes. Há também o silício e a Alemanha amorfos, com aplicações eletrônicas onde eles agem como semicondutores.
E, finalmente, existem ligas amorfas, que, devido à disparidade de seus átomos de metal conformados, eles não estabelecem uma estrutura cristalina.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Rachel Bernstein e Anthony Carpi. (2020). Propriedades de sólidos. Recuperado de: VisionLearning.com
- Wikipedia. (2020). Sólido amorfo. Recuperado de: em.Wikipedia.org
- Richard Zallen, Ronald Walter Douglas e outros. (31 de julho de 2019). Sólido amorfo. Encyclopædia britannica. Recuperado de: Britannica.com
- Elsevier b.V. (2020). Sólido amorfo. Cientedirect. Recuperado de: ScientEdirect.com
- Danielle Reid. (2020). Sólido amorfo: definição e exemplo. Estudar. Recuperado de: estudo.com
- Arte do cubo de Rubik. (2008). O que é um material amorfo? Recuperado de: web.Física.UCSB.Edu
- « Conceito de função social de acordo com o Talcott Parsons, tipos e exemplos
- Estrutura de sólidos cristalinos, propriedades, tipos, exemplos »

