Estrutura de sólidos cristalinos, propriedades, tipos, exemplos

- 2173
- 403
- Terrence King IV
O sólidos cristalinos São aqueles cujas estruturas microscópicas são ordenadas e obedecem a um padrão distinto para uma certa rede cristalina; Por exemplo: cúbico, hexagonal, triclínico, rhomboédrica, entre outros.
Dizem que esses sólidos existem como cristais, que mostram facetas e desenhos geométricos que refletem como pedidos estão dentro. Outros exemplos de sólidos cristalinos são diamante, quartzo, antraceno, gelo seco, cloreto de potássio ou óxido de magnésio.
 Uma barra cristalina de crime. Fonte: Pixabay.
Uma barra cristalina de crime. Fonte: Pixabay. Um par de sólidos cristalinos altamente conhecidos é o de açúcar e sal (NaCl). À primeira vista, ambos usam cristais brancos; Mas suas propriedades diferem muito. O açúcar é um sólido cristalino molecular, enquanto o sal é um sólido cristalino iônico. O primeiro é composto de moléculas de sacarose; E o segundo, de íons Na+ e cl-.
A imagem superior permite vislumbrar como os cristais brilhantes de açúcar podem ser. Cristais de sal, no entanto, eles não estão muito atrás. Embora o açúcar e o sal pareçam irmãos, suas estruturas são diferentes: o açúcar, que se torna sacarose, tem uma estrutura monoclínica; Enquanto sal, uma estrutura cúbica.
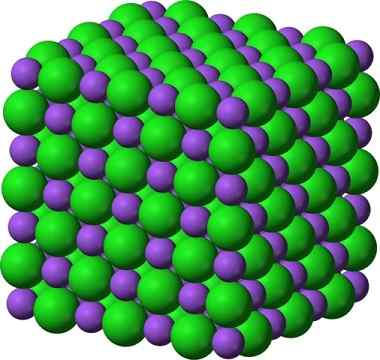 Estrutura cristalina de cloreto de sódio, NaCl
Estrutura cristalina de cloreto de sódio, NaCl O açúcar pulverizado e o sal (GLAS) permanecem cristalinos; Seus cristais só se tornaram muito menores para nossos olhos. A cristalinidade de um sólido, portanto, é definida mais por sua estrutura interna do que por sua aparência externa ou por seus brilhos.
[TOC]
Estrutura de sólidos cristalinos
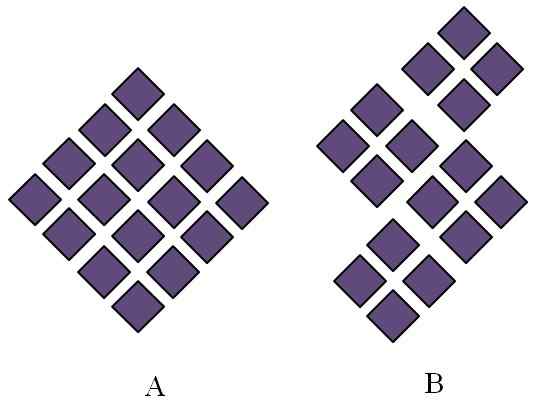 Estruturas ordenadas de sólidos cristalinos. Fonte: Gabriel Bolívar.
Estruturas ordenadas de sólidos cristalinos. Fonte: Gabriel Bolívar. Sólidos cristalinos pediram estruturas. Suas características geométricas dependerão do tipo de rede cristalina à qual pertencem, que por sua vez é projetada externamente nas formas do cristal (sistema cristalino). A imagem superior ilustra dois conceitos importantes de tais estruturas: periodicidade e grãos cristalinos.
Pode atendê -lo: fase de dispersãoO sistema espacial das partículas de um sólido cristalino é o jornal; isto é, é repetido repetidamente em todas as direções. Isso causa seu próprio padrão estrutural para cada rede sólida e cristalina; Por exemplo, é aqui que o sal e o açúcar começam a se diferenciar além de sua natureza química.
Nos Rhombus, eles são ordenados para dar origem a um rombus de maiores proporções. Cada rombus roxo representa uma partícula ou um conjunto deles (átomos, íons ou moléculas). Assim, pode -se esperar que um cristal macroscópico de A tenha uma aparência de Rhomboédica.
Enquanto isso, em B, os Rhombus são ordenados de tal maneira que originem grãos cristalinos; Estes são, cristais muito pequenos (cristalites). Dizem então que B é um sólido poliristal; isto é, é formado pela aglomeração múltiplos cristalitos.
Em conclusão, um sólido pode ser simplesmente cristalino (a) ou poliristalina (b); Em forma de cristais, enquanto polyristales B.
Propriedades
As propriedades dos sólidos cristalinos dependem de seu tipo de vidro. Sabe -se que suas estruturas são ordenadas e que elas também geralmente apresentam facções brilhantes que se apaixonam pelos amantes de minerais. No entanto, foi mencionada que um sólido empoeirado, incluindo "Off", também pode ser classificado como cristalino.
A maneira pela qual suas partículas são espacialmente orientadas permite que elas tenham algumas propriedades importantes para sua caracterização. Por exemplo, sólidos cristalinos são capazes de difratar raios X, criando espectros de difração a partir da qual a estrutura microscópica de um cristal pode ser determinada.
Da mesma forma, como a estrutura é periódica, o calor é disseminado da mesma maneira em todo o sólido; contanto que não haja impurezas entre. Assim, os pontos de fusão para um sólido cristalino são constantes e não variam independentemente de como eles são medidos.
Pode atendê -lo: gálio: propriedades, estrutura, obtenção, usoTipos de sólidos cristalinos
Os tipos de sólidos cristalinos são baseados em que tipo de partículas o compõe e quais são suas interações ou links. Existem quatro tipos: redes iônicas, metálicas, moleculares e covalentes.
Mesmo quando apresentam um certo grau de impurezas, continuam sendo cristalinos, embora suas propriedades sejam afetadas e não mostrem os mesmos valores esperados para um sólido puro.
Iônico
O sal é um exemplo de um sólido cristalino iônico, pois é composto de íons Na+ e cl-. Portanto, nesse tipo de sólidos que o vínculo iônico governa: são as forças eletrostáticas que governam a ordem estrutural.
Metal
Todos os átomos de metal formam cristais metálicos. Isso significa que, por exemplo, um garfo de prata é um conglomerado de cristais de prata fundidos. A estrutura interna ou microscópica é a mesma em cada palma do objeto e permanece inalterada desde a alça do garfo até a ponta dos dentes.
Molecular
O açúcar é um exemplo de um sólido cristalino molecular, pois é formado por moléculas de sacarose. Portanto, esse tipo de sólido consiste em moléculas, que através de suas interações intermoleculares (e ligações não -covalentes) conseguem estabelecer uma estrutura ordenada.
Redes covalentes
Finalmente, temos os sólidos cristalinos de redes covalentes. Eles predominam títulos covalentes, pois são responsáveis por estabelecer uma ordem e manter os átomos fortemente fixados em suas respectivas posições espaciais. Não se fala de íons, átomos ou moléculas, mas de redes tridimensionais.
Exemplos
Em seguida, e finalmente, alguns exemplos serão citados para cada um dos tipos de sólidos cristalinos.
Pode atendê -lo: eletronegatividadeIônico
Todos os sais são sólidos iônicos. Também existem sulfídios, hidróxidos, óxidos, halogenetos e outros compostos que também são formados por íons, ou suas interações estão em essência iônica. Nós temos:
-KCl
-Caso4
-Ba (oh)2
-CUSO4
-FECL3
-N / D2S
-MGO
-Caf2
-Nahco3
-(NH4)2Cro4
Além desses exemplos, a grande maioria dos minerais é considerada sólidos cristalinos iônicos.
Metal
Qualquer elemento metálico é naturalmente apresentado como cristais de metal. Alguns deles são:
-Cobre
-Ferro
-Alumínio
-cromada
-Hidrogênio metálico (sob pressões inimagináveis)
-Tungstênio
-Zircônio
-Titânio
-Magnésio
-Sódio
Molecular
Há uma grande variedade de sólidos cristalinos moleculares. Praticamente qualquer composto orgânico que solidifica o gerenciamento de estabelecer cristais se sua pureza for alta, ou se sua estrutura não for muito intrincada. Então nós temos:
-Gelo (h2QUALQUER)
-Gelo seco (CO2)
-Yo2
-P4
-S8 (e seus polimorfos)
-Antraceno
-Oxigênio sólido
-Amônia sólida
-Fenolftaleína
-Ácido benzóico
Redes covalentes
E, finalmente, entre alguns sólidos cristalinos de redes covalentes que temos:
-Diamante
-Grafite
-Nanotubos de carbono
-Fullerenos
-Quartzo
-Silício
-Germânio
-Nitreto de boro
Nesta lista, nanotubos de carbono e fulereno também podem ser considerados como sólidos cristalinos moleculares. Isso ocorre porque, embora consistam em átomos de carbonos unidos covalentemente, eles definem unidades que podem ser visualizadas como macromoléculas (bolas de futebol e tubos).
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Cristal. Recuperado de: em.Wikipedia.org
- Química Librettexts. (16 de junho de 2019). Sólidos cristalinos e amorfos. Recuperado de: química.Librettexts.org
- Rachel Bernstein e Anthony Carpi. (2020). Propriedades de sólidos. Recuperado de: VisionLearning.com
- « Estrutura de sólidos amorfos, propriedades, exemplos
- Explosão demográfica Causas, consequências, vantagens, desvantagens »

