História do selênio, propriedades, estrutura, obtenção, usa

- 2964
- 630
- Melvin Mueller
Ele selênio É um produto químico não metálico que pertence ao grupo 16 da tabela periódica e é representado pelo símbolo é. Este elemento possui propriedades intermediárias entre enxofre e telurio, que são membros do mesmo grupo.
O selênio foi descoberto em 1817 por Jöhs J. Berzelius e John G. Gahn, que vaporizou a pirita observou um resíduo vermelho (imagem inferior). No começo, eles o confundiram com o telurio, mas depois perceberam que estavam enfrentando um novo elemento.
 Uma garrafa com selênio vermelho amorfo, o alvo mais conhecido para este elemento. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Uma garrafa com selênio vermelho amorfo, o alvo mais conhecido para este elemento. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Berzelius chamou o novo elemento como selênio, baseado no nome de "Selene", que significa "deusa da lua". O selênio é um traço essencial para plantas e animais, embora em altas concentrações seja um elemento tóxico.
O selênio tem três formas alotrópicas principais: vermelho, preto e cinza. Este último tem a propriedade de modificar sua condutância elétrica com base na intensidade da luz que a irradia (fotocondutor), por isso teve muitas aplicações.
O selênio é amplamente distribuído na crosta terrestre, no entanto, os minerais que o contêm não são abundantes; portanto, não há exploração de mineração de selênio.
É obtido principalmente como um produto secundário do processo de refino por eletrólise de cobre. O selênio se acumula no lodo que está no ânodo de células de eletrólise.
Os seres humanos têm cerca de 25 seleenoproteínas, algumas das quais cumprem uma ação antioxidante e controlam a geração de radicais livres. Existem também aminoácidos de selênio, como selenomecção e selenocisteína.
[TOC]
História
Primeira observação
O alquimista Arnold de Villanova pode ter observado o selênio em 1230. Isso foi formado em medicina em Sorbonne de Paris, e até o Doutor do Papa Clemente V.
Villanova em seu livro Rosarium filophorum Descreva um enxofre vermelho ou "reboule de enxofre" que permaneceu em um forno após vaporizar o enxofre. Este enxofre vermelho poderia ter sido um alvo do selênio.
Descoberta
Em 1817, Jöhs Jakob Berzelius e John Gottlieb Gahn descobriram o selênio em uma planta química para a produção de ácido sulfúrico, perto de Gripsholm, Suécia. A matéria -prima para a elaboração do ácido foi a pirita, que extraiu de uma mina do Falun.
Berzelius ficou impressionado com a existência de um resíduo vermelho que permaneceu no recipiente de chumbo depois que o enxofre.
Além disso, Berzelius e Gahn observaram que o resíduo vermelho tinha um forte cheiro de rabanete picante, semelhante ao apresentado pelo Telurio. Razão isso, ele escreveu a seu amigo Marect que eles acreditavam que o depósito observado era um complexo telurio.
No entanto, Blelius continuou a analisar o material depositado incinerando a pirita e reconsiderou que Telurio não havia sido encontrado no Falun. Concluiu em fevereiro de 1818 que ele havia descoberto um novo elemento.
Origem do seu nome
Berzelius apontou que o novo elemento era uma combinação de enxofre e telurio, e que a semelhança do telurio com o novo elemento havia lhe dado a oportunidade de nomear a nova substância de selênio.
Berzelius explicou que "Tellus" significa deusa da terra. Martin Klaport em 1799 colocou este nome para Telurio e escreveu: “Nenhum elemento é chamado apenas dessa maneira. Tinha que ser feito!".
Devido à semelhança do Telurio com a nova substância, Berzelius a chamou com a palavra selênio, derivada da palavra grega "Selene", que significa "deusa da lua".
Desenvolvimento de seus aplicativos
Em 1873, Willoughby Smith descobriu que a condutividade elétrica apresentada pelo selênio dependia da luz que a irradiava. Esta propriedade permitiu que o selênio tivesse inúmeras aplicações.
Alexander Graham Bell em 1979 usou o selênio em seu fotophone. O selênio produz uma corrente elétrica proporcional à intensidade da luz que a ilumina, usando medidores de luz, mecanismos de segurança para a abertura e fechamento de portas, etc.
O uso de retificadores de selênio em eletrônicos começou a partir da década de 1930, com inúmeras aplicações comerciais. Na década de 1970, ele foi substituído nos retificadores para silício.
Em 1957, descobriu -se que o selênio era um elemento essencial para a vida dos mamíferos, pois estava presente em enzimas que protegem do oxigênio reativo e dos radicais livres. Além disso, a existência de aminoácidos como a selenomicção foi descoberta.
Propriedades físicas e químicas
Aparência
Existem vários muitos para o selênio, sua aparência física varia. Geralmente é apresentado como um sólido avermelhado na forma de poeira.
Peso atômico padrão
78.971 u
Número atômico (Z)
3. 4
Ponto de fusão
221 ºC
Ponto de ebulição
685 ºC
Densidade
A densidade de selênio varia dependendo de qual alvo ou polimorfo é considerado. Algumas de suas densidades determinadas à temperatura ambiente são:
Cinza: 4.819 g/cm3
ALFA: 4,39 g/cm3
Vitreous: 4,28 g/cm3
Estado líquido (ponto de fusão): 3,99 g/cm3
Calor de fusão
Cinza: 6,69 kJ/mol/mol
Calor de vaporização
95,48 KJ/mol
Capacidade calórica molar
25.363 J/(mol · k)
Números de oxidação
O selênio pode ser ligado em seus compostos que manifestam os seguintes números ou estados de oxidação: -2, -1, +1, +2, +3, +4, +5, +6. Entre eles, os mais importantes estão -2 (2-), +4 (eu sei4+) e +6 (eu sei6+).
Pode atendê -lo: microscópio simplesPor exemplo, em SEO2 O selênio possui +4 número de oxidação; isto é, a existência do cátion é assumida4+ (ELE4+QUALQUER22-). Semelhante ao SEO3 O selênio tem +6 número de oxidação (i6+QUALQUER32-).
Em hidrogênio seleniuro, h2SE, o selênio tem número de oxidação de -2; isto é, novamente, a existência do íon ou do ânion é assumida para2- (H2+ELE2-). Isso ocorre porque o selênio é mais eletronegativo que o hidrogênio.
Eletro-negatividade
2,55 na escala Pauling.
Energia de ionização
-Primeiro: 941 KJ/mol.
-Segundo: 2.045 KJ/mol.
-Terceiro: 2.973,7 KJ/mol.
Ordem magnética
Diamagnético.
Dureza
2.0 na escala MOHS.
Isótopos
Existem cinco isótopos naturais e estáveis de selênio, que são mostrados abaixo com suas respectivas abundâncias:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Alotropia
 Garrafa preta revestida com um filme fino de Selenium cinza. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Garrafa preta revestida com um filme fino de Selenium cinza. Fonte: w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] O selênio preparado em reações químicas é um pó amorfo vermelho de tijolos, que quando a forma preta vítrea é fundada, semelhante às contas de Rosario (imagem superior). O selênio preto é um sólido quebradiço e lustroso.
Além disso, o selênio preto é levemente solúvel em sulfeto de carbono. Quando esta solução é aquecida a 180 ºC, o selênio cinza precipita, seu mais estável e denso almotrópico.
O selênio cinza é resistente à oxidação e é inerte à ação dos ácidos não -oxidantes. A principal propriedade deste selênio é sua fotocondutividade. Ser iluminado aumenta sua condutividade elétrica em um fator de 10 a 15 vezes.
Reatividade
O selênio em seus compostos existe nos estados de oxidação -2, +4 e +6. Manifesta uma tendência clara de formar ácidos em estados de oxidação mais altos. Os compostos que têm o selênio com o estado de oxidação -2 são chamados seleniuros (2-).
Reação de hidrogênio
O selênio reage com hidrogênio para formar hidrogênio seleniuro (H2SE), um gás incolor, inflamável e fedorento.
Reação de oxigênio
O selênio queima emitindo uma chama azul e formando dióxido de selênio:
ELE8 (s) + 8 o2 => 8 SEO2 (S)
O óxido de selênio é um polímero, substância branca e sólida. Sua hidratação produz ácido seleno (h2SEO3). O selênio também forma o trióxido de selênio (SEO3), Análogo ao enxofre (então3).
Reação com halogênios
O selênio reage com o flúor para formar o Selenium Hexafluoruro:
ELE8 (s) +24 f2 (g) => 8 sef6 (EU)
O selênio reage com cloro e bromo para formar dicloreto e dibromure de disilênio, respectivamente:
ELE8 (s) +4 cl2 => 4 SE2Cl2
ELE8 (S) +4 BR2 => 4 SE2Br2
O selênio também pode formar sef4 e Secl4.
Por outro lado, o selênio forma compostos nos quais um átomo de selênio se junta a um de halogênio e outro de oxigênio. Um exemplo importante é o oxicloreto de selênio (SEO2Cl2), Com selênio em oxidação +6, um solvente extremamente poderoso.
Reação com metais
O selênio reage com metais para formar alumínio, cádmio e seleniuros de sódio. O produto químico abaixo corresponde à formação do seleniuro de alumínio:
3 SE8 + 16 al => 8 a2ELE3
Selenitas
O selênio forma sais conhecidos como selenitas; Por exemplo: selenita de prata (AG2SEO3) e selenita de sódio (NA2SEO3). Este nome foi usado, em um contexto literário, para se referir aos habitantes da lua: os selenitas.
Ácidos
O ácido mais importante de selênio é o ácido focal (h2SEO4). É tão forte quanto o ácido sulfúrico e é mais facilmente reduzido.
Estrutura e configuração eletrônica
- O selênio e seus links
O selênio tem seis elétrons de Valência, e é por isso que está localizado no grupo 16, o mesmo que oxigênio e enxofre. Esses seis elétrons são encontrados em orbitais 4s e 4p, de acordo com sua configuração eletrônica:
[AR] 3D10 4s2 4p4
Portanto, como o enxofre, formam duas ligações covalentes para completar seu octeto de Valência; Embora tenha disponibilidade de seus orbitais 4D para vincular mais de dois átomos. Assim, três átomos de selênio se aproximam e formam duas ligações covalentes: SE-SE-SE.
O selênio com sua maior massa atômica tem uma tendência natural de formar estruturas governadas por ligações covalentes; Em vez de ser organizado como moléculas diatômicas2, SE = SE, análogo a O2, O = O.
- Anéis ou correntes
Entre as estruturas moleculares adotadas por átomos de selênio, dois podem ser mencionados em termos gerais: anéis ou correntes. Observe que no caso hipotético do SE3, Os átomos ainda são exigidos pelas extremidades; Portanto, eles devem se vincular a outros átomos, sucessivamente, até que a corrente possa ser fechada em um anel.
Os anéis mais comuns são os de oito membros ou átomos de selênio:8 (Uma coroa selenita). Por que oito? Porque quanto menor o anel, maior a tensão sofrerá; Isto é, os ângulos de seus links se desviam dos valores naturais definidos por suas hibridizações SP3 (semelhante ao do Cycloalcanos).
Pode atendê -lo: seringa PascalExistem oito átomos, a separação entre os átomos SE é suficiente para que seus links sejam "relaxados" e não "dobrados"; Embora o ângulo de seus links seja 105,7 e não 109,5. Por outro lado, pode haver anéis menores: eu6 e sei7.
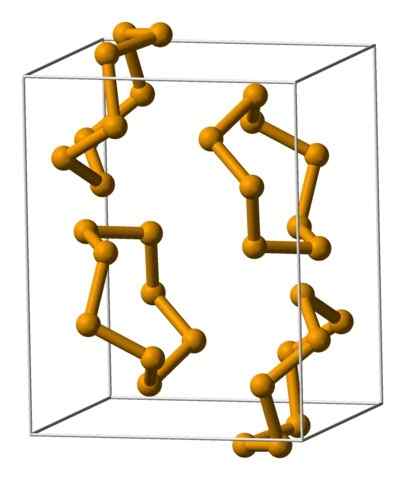 Unidades de analéias de selênio representadas com um modelo de esferas e barras. Fonte: Benjah-BMM27 [Domínio Público].
Unidades de analéias de selênio representadas com um modelo de esferas e barras. Fonte: Benjah-BMM27 [Domínio Público]. Na imagem superior, as unidades de analéres são mostradas8. Observe a semelhança que eles têm com as coroas de enxofre; Só eles são maiores e pesados.
Além dos anéis, os átomos de selênio também podem ser organizados em cadeias helicoidais (pense nas escadas do caracol):
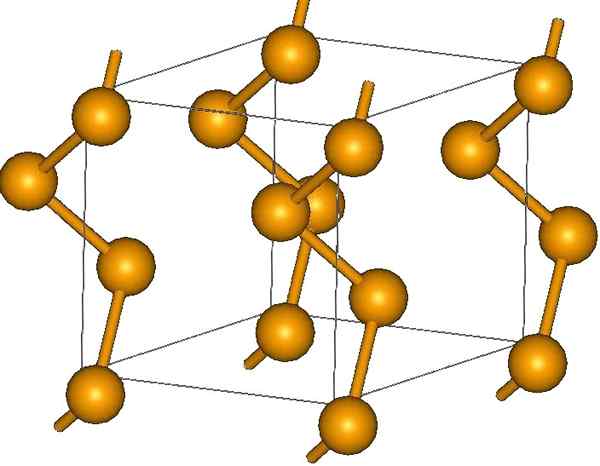 Cadeias de selênio helicoidal. Fonte: Materialscientist na Wikipedia inglesa [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Cadeias de selênio helicoidal. Fonte: Materialscientist na Wikipedia inglesa [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Nas pontas, pode haver links de terminais duplos (-se = se) ou anéis são8.
- Aastoopes
Levando em consideração que pode haver anéis ou correntes helicoidais de selênio e que suas dimensões também podem variar dependendo do número de átomos que eles contêm, é evidente que há mais de um alvo para esse elemento; São sólidos de selênio puro, mas com diferentes estruturas moleculares.
Selênio vermelho
Entre os mais proeminentes, com o selênio, temos vermelho, que pode ser apresentado como uma poeira amorfa ou como cristais monoclínicos e polimórficos (ver imagem dos anéis são8).
No selênio vermelho amorfo, as estruturas são desordenadas, sem padrões aparentes; Enquanto estavam na lente, os anéis estabelecem uma estrutura monoclínica. O selênio vermelho cristalino é polimórfico, com três fases: α, β e γ, que diferem em suas densidades.
Selênio preto
A estrutura do selênio preto também consiste em anéis; Mas não oito membros, mas muitos mais, há até anéis de mil átomos (1000). Dizem então que sua estrutura é complexa e consiste em anéis poliméricos; alguns maiores ou pequenos que outros.
Quando existem anéis poliméricos de tamanhos diferentes, é difícil esperar uma ordem estrutural para estabelecer; Portanto, o selênio preto também é amorfo, mas em contraste com o pó avermelhado mencionado acima, tem contextuais vítreos, embora seja quebradiço.
Selênio cinza
E, finalmente, dos artigos mais simples do selênio é cinza, que se destaca acima dos outros, sendo o mais estável em condições normais e também tendo uma aparência metálica.
Seus cristais podem ser hexagonais ou trigonais, estabelecidos pelas forças de dispersão de Londres entre suas cadeias helicoidais poliméricas (imagem superior). O ângulo de seus links é de 130,1 º, o que indica um desvio positivo dos ambientes tetraédricos (com ângulos de 109,5 °).
É por isso que as cadeias helicoidais de selênio dão a impressão de ser "aberto". Por meio da elucubração, nessa estrutura os átomos são confrontados; portanto, em teoria, deve haver uma sobreposição maior de seus orbitais para criar bandas de direção.
Aqueça com o aumento das vibrações moleculares prejudica essas bandas quando as correntes são desordenadas; Enquanto a energia de um fóton afeta diretamente os elétrons, entrando -os e promovendo suas transações. A partir dessa visão, é "fácil" imaginar fotocondutividade para o selênio cinza.
Onde está e produção
Embora esteja amplamente distribuído, o selênio é um elemento raro. É em estado nativo associado a enxofre e minerais como Eucairita (Cuagse), Cloustalita (PBSE), Naumanita (AG AG2SE) e Crookesite [(Cutiag)2ELE].
O selênio é encontrado como uma impureza que substitui o enxofre em uma pequena porção de minerais sulfurosos de metal; como cobre, chumbo, prata, etc.
Existem solos em que o selênio existe na forma solúvel de selenato. Estes são transportados pelas águas dos chuvas para os rios e a partir daí, em direção ao oceano.
Algumas plantas são capazes de absorver e concentrar o selênio. Por exemplo, um copo de nozes no Brasil contém 544 µg de selênio, uma quantidade equivalente a 777% da quantidade de selênio recomendada diariamente.
Nos seres vivos, o selênio é encontrado em alguns aminoácidos, como: selenomicção, selenocisteína e metilselenocisteína. Selenocisteína e selenita são reduzidos a seleniuro de hidrogênio.
Eletrólise de cobre
Não há exploração de mineração de selênio. A maior parte é obtida como um produto secundário do processo de refino por eletrólise de cobre, estando no lodo que se acumula no ânodo.
O primeiro passo consiste na produção de dióxido de selênio. Para isso, é tratado o Slim Anódico com carbonato de sódio para produzir sua oxidação. Então o óxido de selênio é adicionado água e é acidificado para formar o ácido selênico.
Finalmente, é o ácido seleno com dióxido de enxofre para produzir sua redução e obter o selênio elementar.
Em outro método na mistura de lodo e lama formada na produção de ácido sulfúrico, é obtido um selênio vermelho impuro que se dissolve no ácido sulfúrico.
Ácido selenário e ácido vendernico são então formados. Este ácido selenioso recebe o mesmo tratamento que o método anterior.
O cloro também pode ser usado, que atua em seleniuros de metal para produzir compostos clorados de selênio voláteis; como: eu sei2Cl2, Secl4, Secl2 e Seocl2.
Pode atendê -lo: nível químicoEsses compostos, em um processo realizado na água, tornam -se ácido selendo, que é tratado com dióxido de enxofre para liberar selênio.
Artigo biológico
Deficiência
O selênio é um traço essencial para plantas e animais, cuja deficiência de humanos causou distúrbios graves, como a doença de Keshan; Uma doença caracterizada por danos no miocárdio.
Além disso, a deficiência de selênio está associada à infertilidade masculina e pode desempenhar um papel na doença de Kashin-Beck, um tipo de osteoartrite. Da mesma forma, uma deficiência de selênio foi observada na artrite reumatóide.
Cofator enzimático
O selênio é um componente de enzimas com ação antioxidante, como glupações peroxidase e tiorresodoxina redutase que atuam na eliminação de substâncias com oxigênio reativo.
Além disso, o selênio é um cofator de hormônios da tireóide desiodinases. Essas enzimas são importantes para regular o funcionamento dos hormônios da tireóide.
O uso de selênio foi indicado no tratamento da doença de Hasimoto, uma doença auto -imune com a formação de anticorpos contra células da tireóide.
O selênio também tem sido usado para reduzir os efeitos tóxicos do mercúrio, pois algumas de suas ações são exercidas em enzimas antioxidantes dependentes de selênio.
Proteínas e aminoácidos
O homem tem cerca de 25 seleenoproteínas que exercem uma ação antioxidante para proteção contra estresse oxidativo, iniciado por um excesso de espécies reativas de oxigênio (ERO) e espécies de nitrogênio reativo (NI).
A presença de aminoácidos selenometteocina e selenocisteína em humanos foi detectada. A selenomecção é usada como um suplemento dietético no tratamento de estados de deficiência de selênio.
Riscos
Uma alta concentração corporal de selênio pode ter numerosos efeitos nocivos na saúde, começando com cabelos quebradiços e unhas quebradiças, para erupções cutâneas, calor, edema da pele e dor intensa.
Ao lidar com o selênio em contato com os olhos, as pessoas podem expressar ardor, irritação e lágrima. Enquanto isso, a exposição prolongada a uma fumaça com alto teor de selênio pode causar edema pulmonar, respiração de alho e bronquite.
Além disso, a pessoa pode experimentar pneumonite, náusea, calafrios, febre, dor na garganta, diarréia e hepatomegalia.
O selênio pode interagir com outros medicamentos e suplementos alimentares, como antiácidos, antineoplásicos, corticosteróides, niacina e pílulas para controle de natalidade.
O selênio tem sido associado a um risco aumentado de contrair o câncer de pele. Em um estudo do National Cancer Institute, foi apontado que homens com alta concentração corporal de selênio tinham duas vezes como probabilidade de sofrer de câncer de próstata agressivo.
Um estudo indica que a ingestão diária de 200 µg de selênio aumenta em 50% a possibilidade de desenvolver um diabetes tipo II.
Formulários
Cosméticos
O sulfeto de selênio é usado no tratamento da seborréia, bem como na caspa ou na caspa.
Médicos
É usado como um medicamento alternativo no tratamento da doença de Hasimoto, uma doença auto -imune da tireóide.
O selênio reduz a toxicidade do mercúrio, cujas atividades tóxicas são exercidas em enzimas desoxidantes, que usam o selênio como cofator.
Eletrólise de manganês
O uso de óxido de selênio na eletrólise de manganês reduz consideravelmente os custos da técnica, uma vez que o consumo elétrico diminui.
Pigmento
O selênio é usado como pigmento em pinturas, plásticos, cerâmica e vidro. Dependendo do selênio, a cor do vidro varia de um vermelho profundo a uma laranja claro.
Fotocondutor
Devido à propriedade do selênio cinza de mudar sua condutividade elétrica, dependendo da intensidade da luz que a irradia, o selênio foi usado em fotocopiadoras, fotocipers, fotômetros e células solares.
O uso de selênio em fotocopiadoras foi uma das principais aplicações de selênio; Mas o aparecimento de fotocondutores orgânicos tem diminuído seu uso.
Cristais
O selênio é usado para a descoloração do vidro, como resultado da presença de ferro que produz uma coloração verde ou amarela. Além disso, permite uma coloração vermelha de vidro, dependendo do uso que você deseja dar.
Vulcanização
Dietenio Dietenium é usado como um agente vulcanizante de produtos de borracha.
Ligas
O selênio é usado em combinação com o bismuto no latão, a fim de substituir o chumbo; Elemento muito tóxico que diminuiu seu uso devido às recomendações das agências de saúde.
O selênio é adicionado a baixas concentrações às ligas de aço e cobre para melhorar a facilidade de uso desses metais.
Retificadores
Os retificadores de selênio começaram a ser usados em 1933 até a década de 1970, quando foram substituídos por silício com baixo custo e maior qualidade.
Referências
- Royal Australian Chemical Institute. (2011). Selênio. [PDF]. Recuperado de: raci.org.Au
- Wikipedia. (2019). Selênio. Recuperado de: em.Wikipedia.org
- Sato Kentaro. (s.F.). Novos alotropes dos elementos principais do grupo. [PDF]. Recuperado de: tcichemicals.com
- Dr. Dough Stewart. (2019). Fatos do elemento de selênio. Chemicool. Recuperado de: Chemicool.com
- Robert c. Brasado. (28 de agosto de 2019). Selênio. Encyclopædia britannica. Recuperado de: Britannica.com
- Marques Miguel. (s.F.). Selênio. Recuperado de: Nautilus.Fis.Uc.Pt
- Helmestine, Anne Marie, Ph.D. (3 de julho de 2019). Fatos de selênio. Recuperado de: pensamento.com
- Lentech b. V. (2019). Tabela de período: selênio. Recuperado de: lentech.com
- Tinggi u. (2008). Selênio: seu papel como antioxidante na saúde humana. Saúde ambiental e prevenir medicina, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Escritório de suplementos alimentares. (9 de julho de 2019). Selênio: folha de fatos para profissionais de saúde. Instituto Nacional de Saúde. Recuperado de: SDG.OD.NIH.Gov

