Segunda Lei de Fórmulas, Equações, Exemplos de Termodinâmica

- 1884
- 40
- Alfred Kub
O Segunda Lei da Termodinâmica tem várias formas de expressão. Um deles afirma que nenhuma máquina térmica é capaz de converter completamente toda a energia que absorve em um trabalho utilizável (formulação Kelvin-Planck). Outra maneira de afirmar é dizer que processos reais ocorrem em tal sentido que a qualidade da energia é menor porque o Entropia Tende a aumentar.
Esta lei, também conhecida como o segundo princípio da termodinâmica, foi expressa de maneiras diferentes com a passagem do tempo, desde o início do século XIX até o presente, embora suas origens datam da criação das primeiras máquinas a vapor na Inglaterra, No início do século 18.
 figura 1. Ao construir os blocos de construção no chão, seria muito surpreendente encomendado. Fonte: Pixabay.
figura 1. Ao construir os blocos de construção no chão, seria muito surpreendente encomendado. Fonte: Pixabay. Mas, embora seja expresso de várias maneiras, em toda a ideia que a matéria tende a desordem e que nenhum processo de 100%, uma vez que as perdas sempre existirão sempre existirão.
Todos os sistemas termodinâmicos aderem a esse princípio, começando com o próprio universo na xícara de café da manhã que aguarda silenciosamente sobre a mesa trocando calor com o ambiente.
O café esfria com que o tempo passa, até que esteja em equilíbrio térmico com o meio ambiente, por isso seria muito surpreendente se um dia o oposto acontecesse e a atmosfera esfriaria enquanto o café aqueceria para si mesmo. É improvável que aconteça, alguns dirão isso impossível, mas é suficiente imaginar que ele tenha uma idéia do sentido em que as coisas acontecem espontaneamente.
Em outro exemplo, se deslizarmos um livro na superfície de uma tabela, ele acabará por parar, porque sua energia cinética será perdida na forma de calor devido ao atrito.
A primeira e a segunda lei da termodinâmica foram estabelecidas por volta de 1850, graças a cientistas como Lord Kelvin -criador do termo "Termodinâmica" -William Rankine -autor do primeiro texto formal da termodinâmica -e Rudolph Clausius.
[TOC]
Fórmulas e equações
Entropia -sem o começo -nos ajuda a estabelecer o sentido em que as coisas acontecem. Vamos voltar ao exemplo dos corpos em contato térmico.
Quando dois objetos em diferentes temperaturas são colocados em contato e, finalmente.
Denotando entropia como S, A mudança na entropia ΔS de um sistema é dado por:

A mudança de entropia ΔS Indica o grau de desordem em um sistema, mas há uma restrição no uso dessa equação: é aplicável apenas a processos reversíveis, ou seja, aqueles em que o sistema pode retornar ao seu estado original sem deixar uma marca de que ocorrido-.
Em processos irreversíveis, a segunda lei da termodinâmica se manifesta da seguinte forma:
Pode servir a você: Reynolds Número: Para que é, como é calculado, exercícios
Processos reversíveis e irreversíveis
A xícara de café sempre esfria e é um bom exemplo de um processo irreversível, pois sempre ocorre em uma direção. Se o creme for adicionado ao café e mexer, uma combinação muito agradável será obtida, mas não importa o quão emocionante novamente, o café e o creme não serão novamente, porque a agitação é irreversível.
 Figura 2. A quebra de copo é um processo irreversível. Fonte: Pixabay.
Figura 2. A quebra de copo é um processo irreversível. Fonte: Pixabay. Embora a maioria dos processos diários seja irreversível, alguns são quase Reversível. Reversibilidade é uma idealização. Para ser realizado, o sistema deve mudar muito lentamente, para que a cada ponto esteja sempre em equilíbrio. Dessa forma, é possível devolvê -lo a um estado anterior sem deixar uma marca por perto.
Os processos bastante próximos desse ideal são mais eficientes, pois oferecem uma quantidade maior de trabalho com menos consumo de energia.
A força de atrito é responsável por grande parte da irreversibilidade, porque o calor gerado por ela não é o tipo de energia que é procurada. No livro deslizando sobre a mesa, o calor por atrito é energia que não é recuperada.
Embora o livro retorne à sua posição original, a tabela estará quente como uma pegada de vir e entrar nela.
Agora observe uma lâmpada incandescente: a maior parte do trabalho realizado pela corrente que atravessa o filamento é desperdiçado em calor pelo efeito Joule. Apenas uma pequena porcentagem é usada para emitir luz. Nos dois processos (livro e bulbo), a entropia do sistema aumentou.
Formulários
Um motor ideal é o que é construído através de processos reversíveis e carece de atrito que causa desperdício de energia, virando quase Toda energia térmica no trabalho utilizável.
Enfatizamos quase a palavra, porque nem mesmo o motor ideal, que é de Carnot, tem 100% de eficiência. A segunda lei da termodinâmica não é dessa maneira.
Motor Carnot
O motor de Carnot é o motor mais eficiente que pode ser criado. Opera entre dois depósitos de temperatura em dois processos isotérmicos - a temperatura constante - e dois processos adiabáticos - sem transferência de energia térmica-.
Os gráficos chamados diagramas de pressão PV - volume - esclarecem a situação:
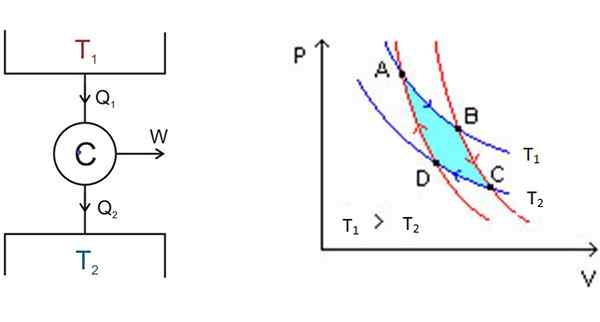 Figura 3. À esquerda, o esquema do motor Carnot e à direita o diagrama P-V. Fonte: Wikimedia Commons.
Figura 3. À esquerda, o esquema do motor Carnot e à direita o diagrama P-V. Fonte: Wikimedia Commons. À esquerda, na Figura 3 está o esquema do motor Carnot C, que leva o calor Q1 do depósito à temperatura t1, converter esse calor em trabalho w e dê resíduos que2 para o depósito mais frio, que está à temperatura t2.
A partir de A, o sistema se expande até atingir B, absorvendo o calor até a temperatura fixa t1. Em B, o sistema inicia uma expansão adiabática na qual o calor não é ganho ou perdido, para chegar a C.
Em c começa outro processo isotérmico: dar calor ao outro depósito térmico mais frio que está em t2. À medida que acontece, o sistema é comprimido e o ponto D é alcançado. Lá começa um segundo processo adiabático para retornar ao ponto de partida para. Dessa maneira, um ciclo é concluído.
Pode servir a você: transferência de calor dirigindo (com exemplos)A eficiência de Carnot depende das temperaturas em Kelvin nos dois depósitos térmicos:
Eficiência máxima = (qEntrada - Qsaída) /QEntrada = 1 - (T2/T1)
O teorema de Carnot afirma que esta é a máquina térmica mais eficiente, mas não se apresse em comprá -lo. Você se lembra do que dissemos sobre a reversibilidade dos processos? Eles têm que acontecer muito, muito lentamente, então a potência de saída desta máquina é praticamente nula.
Metabolismo humano
Os seres humanos precisam de energia para manter todos os seus sistemas funcionando, portanto, eles se comportam como máquinas térmicas que recebem energia e a transformam em energia mecânica para, por exemplo, mover -se.
Eficiência e do corpo humano ao fazer um trabalho pode ser definido como a proporção entre a potência mecânica que ele pode fornecer e a entrada total de energia, que vem com comida.
Como o poder médio Pm É o trabalho realizado em um intervalo de tempo Δt, Pode ser expresso como:
Pm = W/Δt
Sim ΔU/ΔT É a taxa a que a energia é adicionada, permanece a eficiência corporal:

Através de numerosos testes com voluntários, foram obtidas eficiências de até 17%, entregando cerca de 100 watts de energia por várias horas.
Obviamente, isso dependerá amplamente da tarefa que é feita. Pedalar uma bicicleta tem uma eficiência um pouco maior, de cerca de 19 %, enquanto tarefas repetitivas que incluem lâminas, picos e enxadas têm uma eficiência tão baixa quanto aproximadamente 3 %.
Exemplos
A segunda lei da termodinâmica está implícita em todos os processos que ocorrem no universo. A entropia está sempre crescendo, embora em alguns sistemas pareça diminuir. Para que isso tenha aumentado em outros lugares, para que no equilíbrio total seja positivo.
- Ao aprender, há entropia. Há pessoas que aprendem as coisas bem e rapidamente, além de se lembrar delas facilmente. Dizem que eles são pessoas com baixa entropia de aprendizado, mas certamente são menos numerosas do que as de alta entropia: aqueles que mais se lembram das coisas que estudam.
- Uma empresa com trabalhadores desorganizados tem mais entropia do que aquela em que os trabalhadores realizam tarefas de maneira ordenada. É claro que o último será mais eficiente que o primeiro.
- As forças de atrito geram menos eficiência no funcionamento das máquinas, porque aumentam a quantidade de energia dissipada que não pode ser usada com eficiência.
- O lançamento de um dado tem uma entropia maior do que jogar uma moeda no ar. Afinal, o lançamento de uma moeda tem apenas 2 resultados possíveis, enquanto o lançamento dos dados é 6. Quanto mais eventos são prováveis, mais entropia existe.
Pode atendê -lo: quais são os elementos do movimento?Exercícios resolvidos
Exercício 1
Um cilindro com um pistão é preenchido com uma mistura de vapor de líquido e água a 300 K e 750 kJ de calor é transferido para um processo de pressão constante. Como resultado, o líquido dentro do cilindro é vaporizado. Calcule a mudança de entropia no processo.
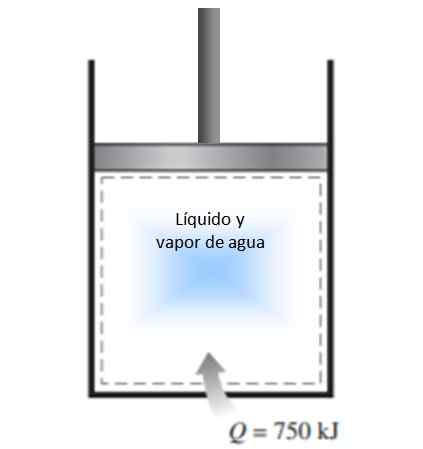 Figura 4. Figura para o exemplo resolvido 1. Fonte: f. Zapata.
Figura 4. Figura para o exemplo resolvido 1. Fonte: f. Zapata. Solução
O processo descrito na declaração é realizado sob pressão constante em um sistema fechado, que não experimenta troca em massa.
Como é vaporização, durante a qual a temperatura não muda (durante as mudanças de fase, a temperatura é constante), a definição de mudança de entropia dada acima pode ser aplicada e a temperatura pode deixar de fora da integral:

ΔS = 750.000 J / 300 K = 2500 J / K.
Como o sistema chega ao sistema, a mudança na entropia é positiva.
Exercício 2
Um gás sofre um aumento de pressão de 2.00 a 6.00 atmosferas (atm), mantendo um volume constante de 1.00 m3, e então expanda a pressão constante até atingir um volume de 3.00 m3. Finalmente volte ao seu estado inicial. Calcule quanto trabalho é realizado em 1 ciclo.
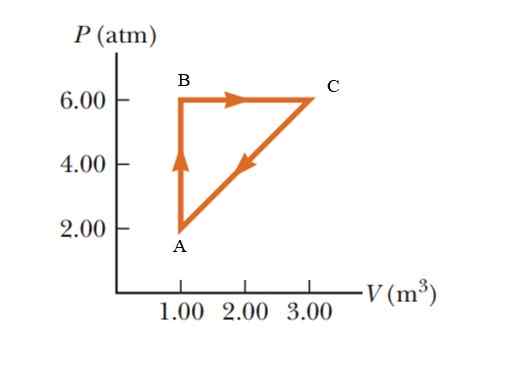 Figura 5. Processo termodinâmico em um gás, por exemplo 2. Fonte: Serway -vulle. Fundamentos da Física.
Figura 5. Processo termodinâmico em um gás, por exemplo 2. Fonte: Serway -vulle. Fundamentos da Física. Solução
É um processo cíclico no qual a variação de energia interna é anulada, de acordo com a primeira lei da termodinâmica, portanto q = w. Em um diagrama P -V (Pressão - Volume), o trabalho realizado durante um processo cíclico é equivalente à área travada pela curva. Para fornecer os resultados no sistema internacional, é necessário alterar as unidades na pressão através do seguinte fator de conversão:
1 atm = 101.325 kpa = 101.325 PA.
A área cercada pelo gráfico corresponde à de um triângulo cuja base (3 - 1 m3) = 2 m3 e cuja altura é (6 - 2 atm) = 4 atm = 405.300 PA
CABCA = ½ (2 m3 x 405300 PA) = 405300 J = 405.3 KJ.
Exercício 3
Dizem que uma das máquinas mais eficientes que foram construídas é uma turbina a vapor alimentada por carvão no rio Ohio, que é usado para dirigir um gerador elétrico que opera entre 1870 e 430 ° C.
Calcule: a) eficiência teórica máxima, b) a energia mecânica fornecida pela máquina se absorvida 1.40 x 105 J de energia a cada segundo do tanque quente. Sabe -se que a eficiência real é 42.0%.
Solução
a) A eficiência máxima é calculada com a equação dada acima:
Eficiência máxima = (qEntrada - Q saída) /QEntrada = 1 - (T2/T1)
Para passar o Celsius para Kelvin, basta adicionar 273.15 Na temperatura Celsius:
Multiplicando por 100%, você tem eficiência percentual máxima, que é 67.2%
c) Se a eficiência real for 42%, há uma eficiência máxima de 0.42.
A energia mecânica entregue é: p = 0.42 x 1.40 x10 5 J/s = 58800 w.
Referências
- Bauer, w. 2011. Física para engenharia e ciências. Volume 1. Mc Graw Hill.
- Cengel, e. 2012. Termodinâmica. 7MA Edição. McGraw Hill.
- Figueroa, d. (2005). Série: Física para Ciência e Engenharia. Volume 4. Fluidos e termodinâmica. Editado por Douglas Figueroa (USB).
- Cavaleiro, r. 2017. Física para cientistas e engenharia: uma abordagem de estratégia.
- López, c. A primeira lei da termodinâmica. Recuperado de: culturacientifica.com.
- Serway, r. 2011. Fundamentos da Física. 9n / D Cengage Learning.
- Universidade Sevilla. Máquinas térmicas. Recuperado de: Laplace.nós.é
- « Princípios, períodos e padrões da teoria do advogado
- Mudanças dos tipos de estado e suas características (com exemplos) »


=0.672)