Mudanças dos tipos de estado e suas características (com exemplos)
- 4155
- 881
- Conrad Schmidt
O mudanças de estado ou a fase é um fenômeno termodinâmico em que a matéria experimenta mudanças físicas reversíveis. Diz -se que é termodinâmico porque ocorre uma transferência de calor entre matéria e ambiente; Ou o que é o mesmo, existem interações entre matéria e energia que induzem um rearranjo de partículas.
As partículas que experimentam a mudança de status permanecem as mesmas antes e depois da mesma. A pressão e a temperatura são variáveis importantes em como elas são acomodadas em uma fase ou outra. Quando ocorre uma mudança de estado, é formado um sistema bifásico, composto pelo mesmo assunto em dois estados físicos diferentes.
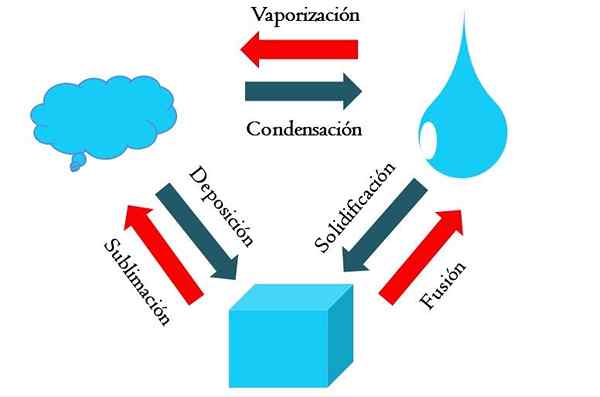
 Mudanças de estado. Fonte: Gabriel Bolívar
Mudanças de estado. Fonte: Gabriel Bolívar A imagem mais alta mostra as principais mudanças de estado que matem as experiências em condições normais.
Um cubo sólido de uma substância azulada pode se tornar líquido ou gasoso, dependendo da temperatura e pressão de seus arredores. Por si só, representa uma única fase: o sólido. Mas, no momento do derretimento, isto é, derreter, um equilíbrio de líquido sólido chamado fusão (seta vermelha entre o balde e a queda azul é estabelecida).
Para que a fusão ocorra, o cubo precisa absorver o calor do ambiente para aumentar sua temperatura; Portanto, é um processo endotérmico. Uma vez que o cubo é derretido, é mais uma vez uma única fase: a do estado líquido.
Este blota pode continuar a absorver o calor, o que aumenta sua temperatura e dá origem à formação de bolhas gasosas. Novamente, existem duas fases: um líquido e o outro refrigerante. Quando todo o líquido evaporou através de seu ponto de ebulição, é dito que ele ferveu ou vaporizou.
Agora, gotas azuladas foram transformadas em nuvens. Até agora, todos os processos foram endotérmicos. O gás azulado pode continuar a absorver o calor até que seja aquecido; No entanto, dadas as condições terrestres, isso pelo contrário tende a esfriar e se condensar novamente no líquido (condensação).
Por outro lado, as nuvens também podem ser depositadas diretamente em uma fase sólida, formando o cubo sólido novamente (deposição). Esses dois últimos processos são exotérmicos (setas azuis); isto é, eles liberam calor para o meio ambiente ou em torno.
Além de condensação e deposição, há uma mudança de estado quando o blota congela a baixas temperaturas (solidificação).
[TOC]
Tipos de mudanças de estado e suas características
A imagem mostra as mudanças típicas para os três estados (mais comuns) de matéria: sólido, líquido e gasoso. As mudanças acompanhadas pelas setas vermelhas são endotérmicas, elas implicam a absorção de calor; Enquanto aqueles acompanhados por setas azuis são exotérmicas.
Uma breve descrição de cada uma dessas mudanças será feita abaixo, destacando algumas de suas características de um raciocínio molecular e termodinâmico.
- Fusão
Fusão é a mudança de estado de uma substância do estado sólido para o líquido.

No estado sólido, as partículas (íons, moléculas, grupos, etc.) são “prisioneiros”, localizados em posições fixas de espaço sem poder se mover livremente. No entanto, eles são capazes de vibrar em diferentes frequências e, se estes forem muito fortes, a ordem rigorosa imposta por forças intermoleculares começará a "desmoronar.
Como resultado, duas fases são obtidas: uma em que as partículas continuam confinadas (sólidas) e outra onde estão mais livres (líquidas), o suficiente para aumentar as distâncias que as separam. Para conseguir isso, o sólido deve absorver o calor e, portanto, suas partículas vibrarão com maior força.
Pode atendê -lo: massa atômica: definição, tipos, como calculá -lo, exemplosPor esse motivo, a fusão é endotérmica e, quando começa, diz-se que ocorre um equilíbrio entre as fases de líquido sólido.
O calor necessário para dar origem a essa mudança é chamado de entalpia de calor ou derretimento (ΔHFus). Isso expressa a quantidade de calor (energia, em unidades KJ principalmente) que deve absorver uma toupeira de substância de estado sólido para derreter, e não simplesmente aumentar sua temperatura.
Bola de neve
 Neve derretido com a mão. Fonte: Pixabay
Neve derretido com a mão. Fonte: Pixabay Com isso em mente, entende -se por que uma bola de neve derrete na mão (imagem superior). A neve absorve o calor do corpo, o que é suficiente para elevar a temperatura da neve acima de 0 ° C.
Os cristais de gelo presentes na neve absorvem o calor certo para derreter e para que suas moléculas de água adotem uma estrutura mais desordenada. Enquanto a neve derrete, a água formada não aumentará sua temperatura, pois todo o calor da mão aproveita a neve para completar sua fusão.
- Vaporização

A vaporização é a mudança de estado de uma substância do estado líquido para o gasoso.
Continuando com o exemplo da água, agora colocando um punhado de neve em uma panela e iluminando o fogo, observa -se que a neve derrete rapidamente. À medida que a água é aquecida, pequenas bolhas de dióxido de carbono e outras possíveis impurezas de gás começam a formar.
 Água fervendo. Fonte: Pixabay
Água fervendo. Fonte: Pixabay O calor dilatou molecularmente as configurações desordenadas da água, expandindo seu volume e aumentando sua pressão de vapor; Portanto, existem várias moléculas que escapam do produto da superfície de aumentar a evaporação.
A água líquida aumenta sua temperatura lentamente, devido ao seu alto calor específico (4.184J/° C ∙ g) g). Há um ponto em que o calor que absorve não o usa mais para aumentar sua temperatura, mas para iniciar o equilíbrio do vapor líquido; Isto é, começa a ferver e todo o líquido passará para o estado gasoso enquanto absorve o calor e mantém a temperatura constante.
É aqui que a bolha intensa é observada na superfície da água cozida (imagem superior). O calor que absorve a água líquida para que a pressão de vapor de suas bolhas incipientes seja igual a pressão externa, é chamada de entalpia de vaporização (ΔHVAP).
O papel da pressão
A pressão também é decisiva nas mudanças estaduais. Qual é o seu efeito na vaporização? Que, a maior pressão, quanto maior o calor que deve absorver a água para ferver e, portanto, é vaporizada acima de 100 ° C.
Isso ocorre porque o aumento da pressão dificulta a escapar das moléculas de água da fase líquida para refrigerante.
Os vasos de pressão usam esse fato a seu favor para aquecer os alimentos na água a uma temperatura acima do ponto de ebulição.
Por outro lado, tendo um vácuo ou diminuição da pressão, a água líquida precisa de uma temperatura mais baixa para ferver e passar para a fase gasosa. Com muita ou pouca pressão, no momento da fervura, a água precisa absorver seu respectivo calor de vaporização para completar sua mudança de estado.
- Condensação
Condensação é a mudança de estado de uma substância do estado gasoso para o estado líquido.
Pode atendê -lo: galactose
A água vaporizou. Que segue? Vapor de água ainda pode aumentar sua temperatura, tornando -se uma corrente perigosa capaz de causar queimaduras graves.
No entanto, suponha que esfrie. Como? Liberando calor para o meio ambiente e, quando liberado, o calor é dito que um processo exotérmico está acontecendo.
Ao liberar calor, as moléculas gasosas de energia começam a desacelerar. Além disso, suas interações começam a ser mais eficazes à medida que a temperatura do vapor desce. Primeiro, gotículas de água, condensado a vapor, seguidas de gotas maiores que acabam sendo atraídas pela gravidade serão formadas.
Para conduzir completamente uma certa quantidade de vapor, você precisa liberar a mesma energia, mas com um sinal oposto, em ΔHVAP; isto é, sua entalpia de condensação ΔHCond. Assim, o equilíbrio reverso e de líquido a vapor é estável.
Janelas umedecidas
 Condensação de água. Fonte: pexels
Condensação de água. Fonte: pexels A condensação pode ser observada nas próprias janelas domésticas. Em clima frio, o vapor de água contido dentro da casa colide com a janela, que por seu material tem temperatura mais baixa do que outras superfícies.
Lá, é mais fácil para as moléculas de vapor agruparem, criando uma fina camada esbranquiçada facilmente removível manualmente. À medida que essas moléculas liberam calor (vidro de aquecimento e ar), eles começam a formar mais numerosos aglomerados até que possam condensar as primeiras gotas (imagem superior).
Quando as gotas aumentam muito seu tamanho, elas deslizam pela janela e deixam uma trilha de água.
- Solidificação
Solidificação é a mudança de estado de uma substância do estado líquido para o estado sólido.

A solidificação ocorre devido ao resfriamento; Em outras palavras, a água congela. Para congelar, a água deve liberar a mesma quantidade de calor que absorve gelo para derreter. Novamente, esse calor é chamado de solidificação ou entalpia de congelamento, ΔHCong (-ΔHFus).
Quando o resfriamento, as moléculas de água perdem energia e suas interações intermoleculares se tornam mais fortes e mais direcionais. Como resultado, eles são ordenados graças às suas pontes de hidrogênio e formam os cristais de gelo tão chamados. O mecanismo pelo qual os cristais de gelo aumentam o impacto em sua aparência: transparente ou branco.
 Escultura de gelo. Fonte: Pixabay
Escultura de gelo. Fonte: Pixabay Se os cristais de gelo crescem muito lentamente, estes não ocluem impurezas, como gases que a baixas temperaturas são solubilizados em água. Assim, bolhas escapam e não podem interagir com a luz; E, consequentemente, há um gelo tão transparente quanto o de uma estátua de gelo extraordinária (imagem superior).
O mesmo que acontece com o gelo pode acontecer com qualquer outra substância que se solidifica pelo resfriamento. Talvez essa seja a mudança física mais complexa nas condições terrestres, uma vez que vários polimorfos podem ser obtidos.
- Sublimação
Sublimação é a mudança de estado de uma substância do sólido para o gás.

Pode água sublim? Não, pelo menos não em condições normais (t = 25 ° C, p = 1 atm). Para a sublimação ocorre, ou seja, a mudança de estado sólido de gás, a pressão de vapor do sólido deve ser alta.
Da mesma forma, é essencial que suas forças intermoleculares não sejam muito fortes, de preferência se elas consistirem apenas em forças de dispersão
O exemplo mais emblemático é um iodo sólido. É um sólido cristalino de tons de cinza-moral, que tem alta pressão de vapor. É tal que, em seu ato.
Pode atendê -lo: trietilamina: estrutura, propriedades, usos e riscos Sublimação de iodo. Fonte: Belkina n V [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)], da Wikimedia Commons
Sublimação de iodo. Fonte: Belkina n V [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)], da Wikimedia Commons Na imagem superior, um experimento típico é mostrado onde o iodo sólido evapora em um recipiente de vidro. É interessante e impressionante observar como os vapores roxos são disseminados e o aluno iniciado pode verificar a ausência de iodo líquido.
Esta é a principal característica da sublimação: não há presença de uma fase líquida. Também é endotérmico, pois o sólido absorve o calor para aumentar sua pressão de vapor para ser igual à pressão externa.
- Deposição
 Depoposição de cristal iodo. Fonte: Stanislav.NevyHosteny [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons
Depoposição de cristal iodo. Fonte: Stanislav.NevyHosteny [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons O depoimento é a mudança de estado de uma substância do estado gasoso para o estado sólido.
Paralelo ao experimento de sublimação de iodo, você tem o depoimento que. Deposição é a mudança ou transição oposta: a substância passa do estado gasoso para o sólido sem a formação de uma fase líquida.
Quando os vapores roxos de iodo entram em contato com uma superfície fria, eles liberam calor para aquecê-lo, perdendo energia e reagrupando suas moléculas novamente no sólido acinzentado (imagem superior). É então um processo exotérmico.
O depoimento é amplamente utilizado para a síntese de materiais, onde eles estão dopando com átomos de metal através de técnicas sofisticadas. Se a superfície estiver muito fria, a troca de calor entre ela e as partículas de vapor é abrupta, omitindo a passagem pela respectiva fase líquida.
O calor ou entalpia de depoimento (e não Deposição) é o da sublimação (ΔHSub=- ΔHD.E.P). Em teoria, inúmeras substâncias podem ser sublimadas, mas para conseguir isso, é necessário manipular pressões e temperaturas, além de ter seu diagrama de p vs t à mão; em que suas fases possíveis distantes podem ser visualizadas.
Outras mudanças de estado
Embora eles não sejam mencionados, existem outros estados da matéria. Às vezes eles são caracterizados por ter "um pouco de cada" e, portanto, uma combinação deles. Para gerá -los, pressões e temperaturas devem ser manipuladas para magnitudes muito positivas (grandes) ou negativas (pequenas).
Assim, por exemplo, se os gases forem muito aquecidos, eles perderão seus elétrons e seus núcleos carregados positivamente naquela maré negativa constituirá o que é conhecido como plasma. É sinônimo de "gás elétrico", pois apresenta alta condutividade elétrica.
Por outro lado, quando as temperaturas descem demais, a matéria pode se comportar sem abaixamento; isto é, eles exibem propriedades únicas em torno de zero absoluto (0 k).
Uma dessas propriedades é a supérflua e a supercondutividade; bem como a formação de condensado de Bose-Einstein, onde todos os átomos se comportam como um.
Até algumas investigações apontam para a matéria fotônica. Neles as partículas de radiação eletromagnética, os fótons, são agrupados para formar moléculas fotônicas. Isto é, seria dar massa a alguns corpos de luz, teoricamente.
Referências
- Helmestine, Anne Marie, Ph.D. (19 de novembro de 2018). Lista de mudanças de fase entre o estado da matéria. Recuperado de: pensamento.com
- Wikipedia. (2019). Estado da matéria. Recuperado de: em.Wikipedia.org
- Dorling Kindersley. (2007). Mudança de estado. Recuperado de: Factmonster.com
- Meyers Ami. (2019). Mudança de fase: evaporão, condensação, frezing, derretimento, sublimação e deposição. Estudar. Recuperado de: estudo.com
- Bagley m. (11 de abril de 2016). Matéria: Definição e o cinco estado da matéria. Recuperado de: LiveScience.com
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- « Segunda Lei de Fórmulas, Equações, Exemplos de Termodinâmica
- Estrutura de iodeto de potássio (KI), propriedades, obtenção, uso, riscos »

