Fórmula de sais básicos, propriedades, nomenclatura, exemplos

- 1824
- 327
- Lonnie MacGyver
As sais básicos São todos aqueles que se dissolvem em água geram soluções com valores de pH maiores que 7. Isso é explicado pela formação de íons OH-, que vêm diretamente do processo de dissolução ou do equilíbrio de hidrólise onde o ânion participa.
Os sais básicos contêm ânion oh- Em seus sólidos. Por exemplo, hidróxidos alcalinos, como sódio e potássio, NaOH e KOH, são considerados membros desses sais; Embora sejam extremamente cáusticos, é por isso que eles merecem a denominação de hidróxidos em vez de serem chamados de sais.
 O hidróxido de sódio é um exemplo de sal básico
O hidróxido de sódio é um exemplo de sal básico Outros sais básicos têm ânions como carbonato, co32-. Carbonato deriva do ácido carbônico, H2Co3, Um ácido fraco. Portanto, sais de carbonato, como carbonato de cálcio utilizados em antiácidos, são classificados como sais básicos. O mesmo raciocínio se aplica ao bicarbonato de sódio, Nahco3, E para todos os outros sais de bicarbonato.
Os sais básicos são importantes porque vários deles ajudam a neutralizar a acidez alimentar. Eles também podem ser usados para preparar soluções de amortecimento para pH alcalino.
[TOC]
Definições
Os sais básicos têm duas definições que se complementam: eles contêm ânions oh- Em seus sólidos, ou gerar esses mesmos ânions hidroxilos depois que seus cristais se dissolvem na água.
Independentemente da definição escolhida, o pH de suas soluções aquosas será maior que 7 e, portanto, elas serão alcalinas ou básicas.
Fórmula geral de sais básicos
Esclarecido o que é entendido pelo sal básico, sua fórmula, embora não estritamente geral, é a seguinte:
Mn(OH)CXOv
Onde m é o cátion metálico ou de amônio, oh os hidroxilos, e xo o ânion derivado de um ácido fraco ou forte. Os subscritos n, C e v quantos M, oh e Xo, respectivamente, compõem o sal básico, bem como suas proporções.
Observe que v Pode ser igual a zero, o que significa que temos um hidróxido alcalino ou alcalinoterreo. É isso que acontece com Naoh e Koh. Da mesma maneira, C Pode ser zero, o que significa que não há íons oh-. Por exemplo, o caco3 Não tem oh-, E ainda assim continua sendo um sal básico.
Pode atendê -lo: sulfeto de cálcio (CAS): estrutura, propriedades, obtenção, usoDo exposto, conclui -se que a fórmula geral de sais básicos é Mn(OH)CXOv, Mas nem todos os sais estão em conformidade com isso. Portanto, um fator mais importante a ser levado em consideração é a natureza do xon ânion. Assim, será sabido quando um sal for básico, independentemente de ter ou não íons oh- Em suas fórmulas.
Propriedades básicas de sais
Os sais básicos se dissolvem na água após a seguinte equação:
Mn(OH)CXOv(s) → nM+(AC) + COh-(AC) + vXO-(AC)
Observe que quando ele dissolve libera íons oh- na água. Isso afeta o pH da solução, tornando -se alcalino com um valor maior que 7. Por exemplo, o nitrato básico de cálcio se dissolve na água de acordo com o que se segue:
CA (oh) não3(s) → Ca2+(AC) + OH-(AC) + não3-(AC)
Os valores de n, C e v Eles são iguais a 1 para este sal.
Por outro lado, os sais básicos que não têm oh-, Mas um ânion derivado de um ácido fraco é hidrolisado na água:
Ladrão3(s) → Ca2+(AC) + CO32-(AC)
Co32-(AC) + H2Ou (l) ⇌ HCO3-(AC) + OH-(AC)
Observe que o produto desta hidrólise é um ânion oH-. A partir daí está a alcalinidade dessas bases. No entanto, e como esperado, eles são menos básicos do que aqueles que já têm os íons oh- presente em seus cristais. Por exemplo, o NaOH é extremamente básico:
NaOH (s) → Na+(AC) + OH-(AC)
Bem, libere os íons oh- diretamente assim que a água toca; Ou pior, mal toca a umidade da pele.
Pode atendê -lo: carbocação: formação, características, tipos, estabilidadeOutras propriedades físicas ou químicas dos sais básicos não diferem muito daquelas de outros sais neutros ou ácidos.
Nomenclatura
A nomenclatura dos sais básicos depende da natureza do ânion xo: se for monoatômico, ou se for um oxoanion. No entanto, esta seção se concentrará especialmente em sais básicos com ânions OH-. Aqueles que não os têm, têm nomenclaturas muito mais fáceis de memorizar ou raciocinar.
Com ânions monoatômicos
Ânions monoatômicos não são representados como XO, mas como x. Eles derivam de um hidraceto HX, como ácido fluoreto, HF ou ácido clorídrico, HCl, e assim por diante.
Nesses casos, eles são nomeados sistematicamente de duas maneiras:
(Prefixo numeral, exceto o macaco) Hydroxi + Nome do ânion terminando com o sufixo -Uro + nome do metal com sua valência entre parênteses (se tiver mais de um)
Por exemplo, Salt Ni (OH) Cl é chamado de hidroxicloreto de níquel (II).
Nome do ânion com terminação -Uro + -(prefixo numeral, exceto macaco) Hidróxido + nome de metal e sua valência entre parênteses
Por exemplo, Salt Ni (OH) CL também pode ser nomeado como cloreto de níquel-hidróxido (II).
Também temos a nomenclatura tradicional, às vezes misturada com os sistemáticos:
Nome do ânion seguido de (prefixo numeral, exceto o macaco) básico e o nome do metal com os sufixos -ooso ou -ico como aplicado.
Por exemplo, o Ni (OH) CL é chamado de cloreto básico de níquel, ou cloreto de níquel básico (II).
Com oxoaniões
A nomenclatura sistemática para sais básicos que possuem oxoaniões é um pouco mais complicado. No entanto, a versão mais simples é construída da seguinte maneira:
(Prefixo numeral) hidróxido- (nome do ânion) + de + nome de metal e sua valência entre parênteses
Por exemplo, fé (oh) não3 é chamado: nitrato de hidróxido-ferro (ii).
Ele também tem a nomenclatura tradicional:
NION BASIC NION + (Numeral Prefix) + Nome de metal terminando em -Oso ou -ico
Pode atendê -lo: oxigênio: propriedades, estrutura, riscos, usosAssim, fé (oh) não3 É chamado: nitrato básico ferroso ou nitrato básico de ferro (ii).
Treinamento
Os sais básicos são o produto de neutralizações ácidas-base, especificamente entre uma hidratia ou um oxoácido com um excesso de base ou hidróxido:
Base (excesso) + ácido → sal básico ou alcalina + água
Por exemplo, CA (oh) não3 É formado neutralizando o ácido nítrico com um excesso de hidróxido de cálcio:
CA (OH)2(Excesso) + hno3 → Ca (oh) não3 + H2QUALQUER
Outra formação de treinamento seria a seguinte:
Fé (oh)3(Excesso) + h2SW4 → Fe (oh) então4 + 2h2QUALQUER
Este sal é chamado: sulfato férrico básico, sulfato básico de ferro (iii) ou hidróxido de ferro-sulfato (iii).
Exemplos de sais básicos
 Antiácidos, como carbonato de cálcio, CaCO3, são exemplos de sais básicos. Fonte: Pixabay.
Antiácidos, como carbonato de cálcio, CaCO3, são exemplos de sais básicos. Fonte: Pixabay. Finalmente, alguns outros exemplos de sais básicos serão listados juntamente com seus nomes mais simples:
-Nach3COO: acetato de sódio
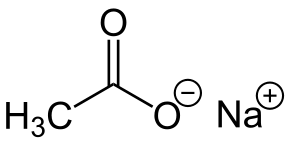 Acetato de sódio
Acetato de sódio -N / D2S: sulfeto de sódio
 Sulfeto de sódio
Sulfeto de sódio -KCN: cianeto de potássio
-MGCO3: Carbonato de Magnésio
-Fé (oh) então3: Sulfito básico de ferro (iii)
-Fé (oh) (c6H5COO)2: Benzoato de ferro básico (iii)
-AUCL (OH)2: Cloreto dibásico de ouro (iii)
-CUCLO3(OH): clorato básico de cobre (ii)
-Em (oh) então4: Sulfato básico de alumínio
-PB (OH)2Co3: Carbonato de chumbo dibásico (IV)
O problema dos sais básicos é que nem todos eles podem ser preparados, porque um excesso de base ou hidróxido não é suficiente para cristalizá -los sem recorrer a outros processos. Esse é o caso de PB (OH)2Co3. No entanto, esse carbonato existe como um pigmento de chumbo branco (ii), cuja fórmula é 2pbco3· PB (OH)2 ou pb3(OH)2(Co3)2.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Sal alcalino. Recuperado de: em.Wikipedia.org
- Wu c., Dowell c. & Hooper n. (1 de julho de 2014). Propriedades ácidas da base de sais. Recuperado de: química.Librettexts.org
- Nicola McDougal. (2020). Soluções de sal ácido e básico: explicação e exemplo. Estudar. Recuperado de: estudo.com
- Problema e exercícios químicos. (s.F.). Sais básicos. Recuperado de: acorral.é
- « Conceito e exemplos Estrutura de material
- Características de função escalonadas, exemplos, exercícios »

