Regra do octeto

- 4358
- 203
- Terrence King IV
 Representação de uma molécula de dióxido de carbono mostrando conformidade com a regra do octeto
Representação de uma molécula de dióxido de carbono mostrando conformidade com a regra do octeto Qual é a regra do octeto?
O Regra do octeto É uma regra prática que explica a formação da ligação química dos elementos representativos com base na configuração eletrônica de sua camada de valência.
De acordo com esta regra, os átomos se combinam entre si de tal maneira que cada átomo é cercado por oito elétrons em sua camada de valência (daí a palavra octeto).
Esta regra foi publicada simultaneamente em 1.916 Tanto Gilbert Lewis quanto Walther Kossel. Reflete a observação de que os gases nobres são muito estáveis e tudo, com exceção do hélio, eles são caracterizados por ter sua camada de valência com 8 elétrons.
A teoria estabelece que os átomos compartilham ou trocam elétrons, formando ligações químicas, a fim de adquirir esta configuração eletrônica de camadas completas.
A regra do octeto e as estruturas de Lewis
A regra do octeto e as estruturas de Lewis estão intimamente relacionadas. Isso ocorre porque a regra do octeto é uma das bases para entender a formação da ligação química, por isso permite prever na maioria dos casos, a estrutura de Lewis dos produtos químicos.
Nesse sentido, uma das etapas essenciais para desenhar uma estrutura de Lewis, depois de colocar links simples entre todos os átomos que formam a molécula, é distribuir os restantes elétrons de valência entre os átomos mais eletronegativos para completar seus octetos.
Nos casos em que os octetos estão sem encher, são formadas ligações duplas ou triplas, sempre procurando a regra do octeto para o maior número possível de átomos. Portanto, esta regra empírica é essencial para a construção de estruturas de Lewis.
Pode atendê -lo: Silver Yoduro (AGI): estrutura, propriedades, obtenção, usosExemplos de conformidade com a regra do octeto
A regra do octeto é aplicada principalmente aos elementos representativos, isto é, aos dos blocos S e P da tabela periódica. Esta regra é consistentemente aplicada a compostos que contêm carbono, nitrogênio, oxigênio e halogênios e com algumas exceções aos outros elementos do bloco P. No entanto, a maioria dos metais de transição não cumpre.
Alguns exemplos de compostos em que a regra do octeto é cumprida para todos os átomos:
Dióxido de carbono (CO2)
Como pode ser visto na estrutura de Lewis do dióxido de carbono apresentado abaixo, tanto o carbono central quanto os átomos de oxigênio estão em conformidade com a regra do octeto.
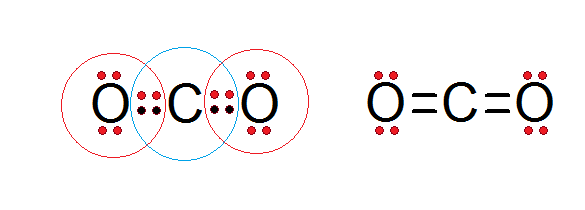
O carbono é cercado por seus 4 elétrons de valência, além de dois elétrons de cada oxigênio, que contribuem para formar as ligações duplas C = O, enquanto cada oxigênio é cercado por 6 elétrons próprios, além de um par de carbono.
Neopentano (c5H12)
Na grande maioria dos compostos orgânicos, todos os átomos cumprem a regra do octeto (exceto o hidrogênio cercado por apenas 2 elétrons). Isso inclui alcanes como Neopentano ou 2.2-dimetilpropano:
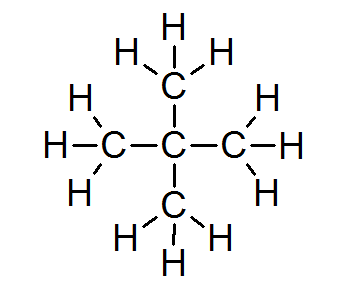
Nesse caso, também se pode observar que cada átomo de carbono compartilha seus quatro elétrons com 4 átomos vizinhos, cada um dos quais fornece um de seus elétrons para formar as 4 ligações covalentes simples que se mantêm juntas.
Por esse motivo, cada átomo de carbono é cercado por 8 elétrons de valência, cumprindo a regra do octeto.
Pode atendê -lo: energia de ativaçãoMonóxido de carbono (CO)
O monóxido de carbono é outro composto molecular no qual oxigênio e os elétrons de compartilhamento de carbono formam uma ligação covalente para satisfazer a regra do octeto.
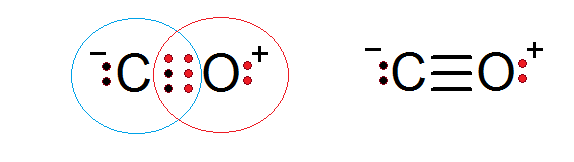
Nesse caso, o carbono fornece dois elétrons e oxigênio 4 para completar os 6 elétrons necessários para formar a ligação covalente tripla que os une. Cada um dos dois átomos tem elétrons adicionais sem compartilhar que completam cada octeto.
Ânion nitrato (não3-)
Também no caso de íons, a regra do octeto é cumprida. O íon nitrato tem um átomo de nitrogênio central cercado por 3 átomos de oxigênio.
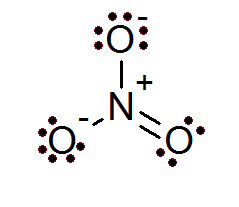
Como pode ser visto neste caso, todos os átomos têm seu octeto completo, dois do oxigênio têm uma carga formal negativa, enquanto o nitrogênio tem uma carga formal positiva, o que resulta na carga líquida de -1 Íon nitrato.
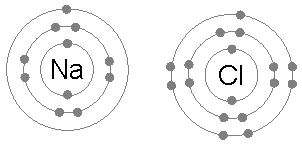
Cloreto de sódio (NaCl)
A troca de elétrons para formar compostos iônicos também é um exemplo comum da aplicação da regra do octeto.
Quando o cloreto de sódio é formado a partir de cloro e sódio, ele começa com dois átomos que não cumprem a regra do octeto, uma vez que o sódio em um elétron e cloro não possui um para completar seu octeto.
Então, o sódio dá seu elétron ao cloro, deixando o cátion cercado por 8 elétrons e, por sua vez, completando o octeto ao cloro, formando o íon cloreto.
 Exceções à regra do octeto
Exceções à regra do octeto
Assim como há um grande número de compostos nos quais todos os átomos cumprem a regra do octeto, também existem vários exemplos de átomos que não cumprem.
Pode atendê -lo: potencial z: valores, diplomas de coagulação, determinação, usosAlguns são cercados por menos de 8 elétrons, então eles são Espécies de elétrons ruins, enquanto outros estão cercados por mais de oito elétrons, nesse caso, diz -se que ele tem um octeto expandido ou é chamado Átomo hipervalente.
Exemplos de espécies de elétrons ruins
Bordean (BH3)
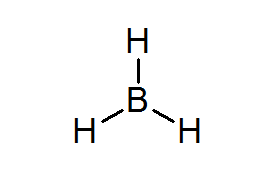
Este composto é um exemplo típico de um tipo pobre de elétrons. Nem o boro nem os hidrogênios circundantes, têm elétrons suficientes para satisfazer a regra do octeto no átomo central. Isso faz com que o boro receba alguns elétrons de outro átomo em outra molécula, transformando o Bordeal em um ácido de Lewis.
Triclurur de alumínio (ALCL3)
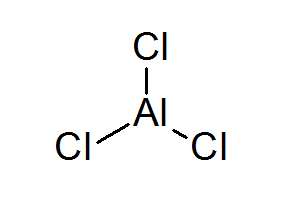
O alcl3 É outro exemplo de um ácido de Lewis que deve seu comportamento químico ao qual não atende à regra do octeto.
Exemplos de espécies hipervaluentes
Hexafluoruro de enxofre (SF6)
Um exemplo típico de um octeto expandido é o SF6, que geralmente é representado como um enxofre central com 6 ligações covalentes simples com átomos de flúor. Nesse caso, o enxofre está cercado por 12 elétrons de valência em vez de 8, por isso viola a regra do octeto.
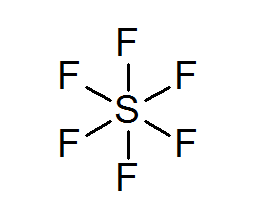
Apesar disso, foram propostos modelos nos quais o enxofre está realmente ligado a ligações covalentes a 4 fluores ao mesmo tempo, enquanto com os outros dois, formam ligações iônicas. Nesse caso, cumpriria a regra do octeto.
Pentacloreto de fósforo (PCL5)
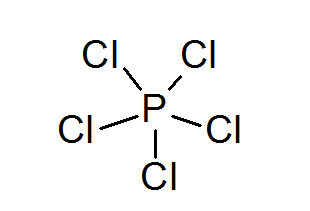
Como no caso de enxofre, o fósforo também pode formar compostos com octetos expandidos, neste caso, cercados por 10 elétrons.

