Princípio da Aufbau

- 4966
- 1423
- Ernesto Bruen
 Orbitais atômicos Ordem de preenchimento de acordo com o princípio da Aufbau
Orbitais atômicos Ordem de preenchimento de acordo com o princípio da Aufbau Qual é o princípio da Aufbau?
Ele Princípio da Aufbau, Também conhecido como regra chuvosa ou princípio de construção, é uma regra prática que permite prever a configuração eletrônica da grande maioria dos elementos da tabela periódica, bem como a de seus íons.
Esse princípio estabelece que, à medida que os prótons são adicionados ao núcleo, um a um para construir sucessivamente cada elemento químico, os elétrons também são adicionados sucessivamente aos orbitais atômicos de menor energia que estão disponíveis.
Em outras palavras, Aufbau estabeleceu que há uma ordem específica de acordo com a qual os orbitais atômicos podem ser preenchidos. Este pedido é explicado abaixo.
A ordem de preenchimento dos orbitais de acordo com o princípio de Aufbau
A ordem em que os orbitais atômicos são preenchidos depende de seu nível de energia. A regra de ouro é que esses níveis de energia são preenchidos do menos para o maior, como se fosse um edifício no qual os apartamentos deveriam ser preenchidos nos andares mais baixos para acessar os andares mais altos.
Nesse sentido, para prever a ordem de preenchimento dos orbitais, devemos primeiro saber como eles são ordenados de acordo com o nível de energia deles. Na analogia do edifício, isso significa saber quais apartamentos (orbitais) existem em cada andar.
O gráfico a seguir mostra os níveis de energia dos primeiros orbitais atômicos ordenados da menor a maior energia.
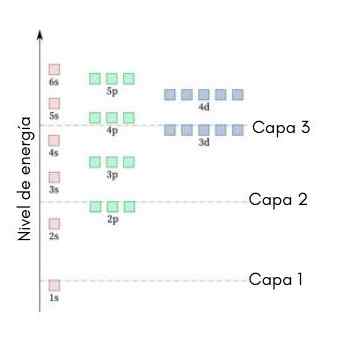
Nesta imagem, cada imagem representa um orbital específico no qual apenas 2 elétrons se encaixam. Cada grupo de pinturas da mesma cor representa um sub -nível de energia.
Esses sub -níveis são identificados por um número e uma letra (1s, 3p, 3d, etc.). O número indica o nível de energia principal, enquanto a letra indica o tipo de orbital que forma o grupo.
Pode servir você: cloreto de alumínio (ALCL3)De acordo com esse esquema, o primeiro sub -nível que deve ser preenchido é o 1S (o mínimo de energia de todos), então vem os 2s, os 2p, os 3s, os 3p, os 4s, o 3d e assim por diante.
A regra da chuva
Apesar de fácil estabelecer a ordem de preenchimento se você tiver um gráfico como o anterior, é difícil lembrar a ordem específica em que os diferentes sub -níveis vão. Para isso, o que alguns chamam de "a regra da chuva" é usado.
Esta regra consiste em duas etapas simples:
Passo 1
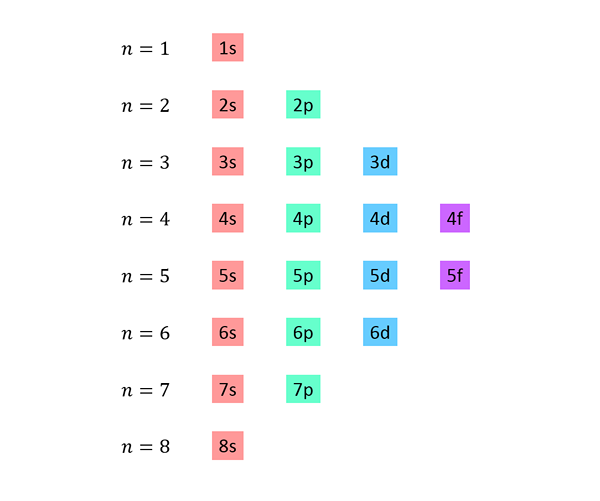
É feita uma lista na qual cada linha corresponde a um nível de energia e contém um após o outro, todos os sub -níveis disponíveis nesse nível de energia.
Por exemplo, a primeira linha corresponde ao nível 1 (n = 1) e contém apenas o sub -nível 1S; A segunda linha corresponde ao nível n = 2 e contém sub -níveis 2s e 2p; O terceiro contém os sub -níveis 3s, 3p e 3d.
A lista completa se parece com o seguinte:
Passo 2
Diagonais descendentes são desenhadas da direita para a esquerda, uma abaixo da outra, como mostrado abaixo.
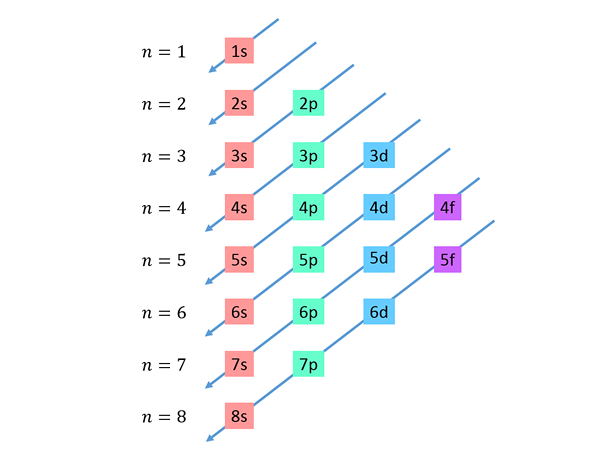
Essas linhas se assemelham à rota de gotas de água durante um vento com vento, então este gráfico geralmente é chamado de "o método da chuva". A ordem de enchimento é determinada pela ordem em que essas diagonais estão tocando os sub -níveis da lista.
Com base na figura anterior, a ordem de energia dos orbitais e, portanto, a ordem em que eles devem ser preenchidos é:
Pode atendê -lo: mesa quântica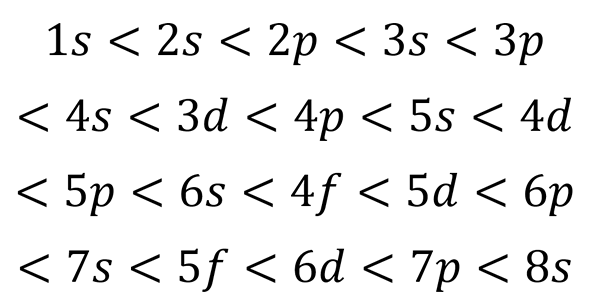
Esta ordem de preenchimento é a única que realmente importa ao escrever a configuração eletrônica de um átomo. Ao preencher esses sub -níveis, deve -se lembrar que nos sub -níveis s Apenas 2 elétrons se encaixam p ajuste 6, no d Eles se encaixam 10 e no F Eles se encaixam em 14.
Exceções no início de Aufbau
O princípio da Aufbau estabelece claramente que um sub -nível não pode ser preenchido até que todos os sub -níveis anteriores tenham preenchido completamente. No entanto, existem algumas exceções a esta regra.
Em alguns casos, o átomo prefere ter um sub -nível de energia preenchida precisamente pela metade do que ter um incompleto que não está cheio ao meio. Nesses casos, a configuração eletrônica real do átomo não corresponde à ordem prevista pelo método de chuva.
Por exemplo, de acordo com o princípio da Aufbau, o Atom Chrome deve ter uma configuração eletrônica que termine no 4S2 3d4. No entanto, sua configuração real é 4s1 3d5 Como assim os sub -lados 4s e 3D são preenchidos ao meio, enquanto na outra configuração não.
O mesmo vale para o cobre cuja configuração termina em 4s1 3d10, em vez de 4s2 3d9, uma vez que preenche o sub -nível d e s está cheio ao meio.
Exemplos da aplicação do princípio da Aufbau
Em seguida, existem 5 exemplos de elementos que atendem ao princípio da Aufbau:
Exemplo 1: Configuração eletrônica de sódio
O sódio é o elemento 11, por isso possui 11 prótons e 11 elétrons. Sua configuração eletrônica é 1s2 2s2 2 p6 3s1.
Exemplo 2: Configuração eletrônica de argônio
O argônio (AR) é o elemento 18, por isso possui 18 prótons e 18 elétrons. Sua configuração eletrônica é, portanto, 1s2 2s2 2 p6 3s23p6. Pode -se ver que seus sub -níveis e sub -níveis eram completamente.
Pode atendê -lo: propileno (C3H6)Exemplo 3: Configuração eletrônica de gálio
Gálio (GA) é o elemento 31, por isso possui 31 prótons e 31 elétrons. Sua configuração eletrônica é 1s2 2s2 2 p6 3s23p64s23d104p1.
Isso pode ser escrito de uma maneira resumida como [AR] 4s23d104p1, onde [AR] representa a configuração eletrônica de argônio apresentada no exemplo anterior.
Exemplo 4: Configuração eletrônica de carbono
Carbono (c) é elemento 6, por isso possui 6 prótons e 6 elétrons. Sua configuração eletrônica é 1s2 2s2 2 p2.
Exemplo 5: Configuração eletrônica de cloro
Cloro (CL) é elemento 17. Seus 17 elétrons são distribuídos de acordo com a seguinte configuração eletrônica: 1s2 2s2 2 p6 3s23p5 ou [ne] 3s23p5.
Exemplos adicionais de exceções no início de Aufbau
Em seguida, existem 2 exemplos adicionais de elementos que violam o princípio da Aufbau:
Exemplo 6: Configuração eletrônica de molibdênio
Molibdênio (MO) é elemento 42. Os 36 primeiros elétrons são distribuídos da mesma maneira que no Crypton, mas seus elétrons de valência não seguem o pedido normal. Em vez de ter configuração eletrônica [KR] 5S24d4, Sua configuração é [KR] 5s14d5, Semelhante ao que acontece com o Chrome.
Exemplo 7: Configuração eletrônica de prata
La Plata (AG, elemento 47) apresenta uma violação do princípio da Aufbau semelhante ao de cobre. Sua configuração eletrônica é [KR] 5S14d10 Em vez de [KR] 5S24d9.

