Afinidade eletrônica

- 2109
- 662
- Tim Mann
O que é afinidade eletrônica?
O Afinidade eletrônica É definido como a quantidade de energia liberada quando um mol de átomos no estado gasoso é combinado com um mol de elétrons para formar uma toupeira de ânions, também em um estado gasoso. Em outras palavras, refere -se ao negativo da variação de entalpia do seguinte processo:
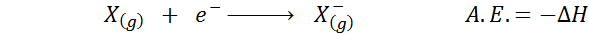
Como o nome indica, a afinidade eletrônica (a.E.) É uma medida da tendência que tem um átomo para se juntar a um elétron. Isto é, ele mede a afinidade de um átomo para elétrons.
Interpretação da afinidade eletrônica
Devido à maneira como é definida, uma alta afinidade eletrônica implica que a variação de entalpia é muito negativa. Isso, por sua vez, indica que o processo é energeticamente favorável e que os produtos são mais estáveis do que os reagentes. Por esse motivo, também poderíamos dizer que a afinidade eletrônica é uma medida indireta da estabilidade de um ânion.
Quanto maior a afinidade eletrônica de um átomo, maior a tendência de formar o ânion. É por isso que átomos como cloro, cuja afinidade eletrônica é de 349 kJ/mol, tendem a formar ânions facilmente (neste caso, ânion de cloreto), enquanto outros átomos como o magnésio, cuja afinidade eletrônica é negativa, não formam ânions.
Esclarecimento sobre afinidade eletrônica e energia de ionização
Muitas vezes você pensa sobre a afinidade eletrônica como o oposto da energia de ionização (a tendência de um átomo gasoso de perder um elétron), mas isso não é assim. Considere, por exemplo, um átomo x.
Pode servir a você: Tusfrano: Estrutura química, propriedades e usosSua afinidade eletrônica refere -se à mudança de energia do processo mostrado acima na primeira equação. No entanto, sua energia de ionização refere -se à mudança de energia quando o átomo perde um elétron:
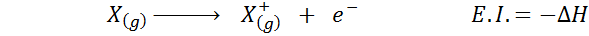
Embora essa reação pareça ser a reação oposta ao anterior.
O que determina a afinidade eletrônica?
Para saber quais características de um átomo influenciar o valor de sua afinidade eletrônica, a estabilidade do átomo original deve ser considerada, bem como o do ânion que é formado. Se o ânion for mais estável que o átomo, a afinidade eletrônica será alta, caso contrário, será baixo ou até negativo.
Mas como saber qual das duas espécies é mais estável? Para isso, contamos com dois fatores:
- Configuração eletronica. Existem configurações eletrônicas mais estáveis do que outras. Em geral, a configuração completa da camada (como gases nobres) é o mais estável de todos. Em seguida, é seguido pela configuração da camada semi-llena, na qual todos os orbitais da camada de Valência têm metade dos elétrons que eles poderiam ter (por exemplo, 4s14p3).
- Repulsão eletrônica. Se um ânion de carga -1 for comparado, com um ânion de carga -2, no segundo caso, haverá muito mais repulsão entre elétrons, o que desestabiliza o ânion.
Tendência periódica de afinidade eletrônica
 Gráfico mostrando as afinidades eletrônicas dos 9 primeiros elementos da tabela periódica
Gráfico mostrando as afinidades eletrônicas dos 9 primeiros elementos da tabela periódica A afinidade eletrônica é uma das propriedades periódicas dos elementos. Isto é, é uma propriedade que varia previsivelmente de um elemento para outro, dependendo de sua posição na tabela periódica. Em termos gerais, a afinidade eletrônica aumenta à medida que o tamanho do átomo diminui.
Pode servir a você: fórmula semi -desenvolvida: o que são e exemplos (metano, propano, butano ...)Nesse sentido, o tamanho dos átomos varia dependendo do período e do grupo em que está localizado, de modo que sua afinidade eletrônica também varia conforme explicado abaixo:
Variação da afinidade eletrônica durante um período
Pelo menos para os elementos representativos (aqueles pertencentes aos blocos S e P da tabela periódica), pode -se observar que a afinidade eletrônica tem uma tendência geral de aumentar da esquerda para a direita, devido ao aumento da carga nuclear efetiva que é capaz de atrair elétrons com maior força.
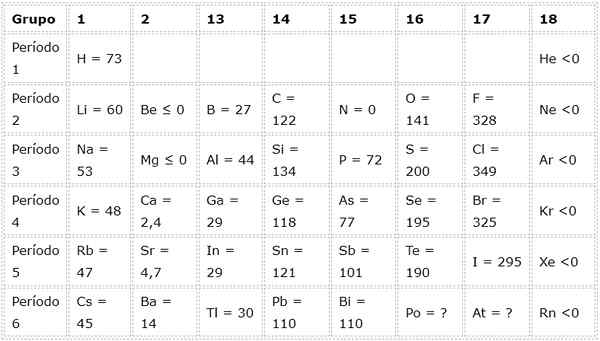
Por exemplo, se tomarmos o terceiro período da tabela periódica, podemos ver que a afinidade eletrônica do LI (60 kJ/mol) é menor que a do oxigênio (141 kJ/mol) e isso é menor que o do fluoreto (328 kJ /mol).
Exceções
A regra anterior nem sempre é cumprida.
Primeiro, ao passar de metais alcalinos para alcalinos, a afinidade eletrônica diminui. Isso ocorre porque para metais alcalinos (configuração eletrônica ns1) É favorável capturar um elétron, pois eles terminariam de encher seus orbitais.
No caso de Alkalineros (configuração eletrônica NS2) capturar um elétron é desfavorável porque eles já têm seu orbital completo. O mesmo acontece ao passar de halogênios (que têm as afinidades eletrônicas de todos os elementos) para os gases nobres.
Variação da afinidade eletrônica em todo um grupo
No caso de grupos, o comportamento é ainda menos previsível. A regra geral é que o A.E. aumenta de baixo para cima, na mesma direção que diminui o raio atômico. Para metais alcalinos e halogênio, esta regra é cumprida muito bem. No entanto, isso não acontece com a maioria dos outros grupos.
Pode atendê -lo: hidróxido de cobaltoExemplos de afinidade eletrônica de alguns elementos representativos
A tabela a seguir mostra valores de afinidade eletrônica em (KJ/mol) de Os elementos representativos Classificado pelo grupo:
Abaixo estão alguns exemplos de afinidade eletrônica, juntamente com a reação à qual eles se referem:
1. Afinidade eletrônica de hidrogênio
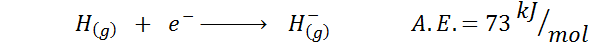
2. Afinidade eletrônica de oxigênio
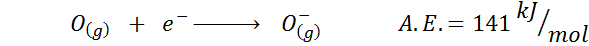
3. Afinidade eletrônica do ânion
Outro exemplo comum é o caso de afinidade eletrônica de um ânion como ou-. O a.E. Nesse caso, é dado pela energia associada ao seguinte processo:
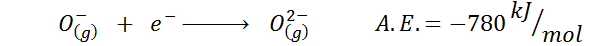
Como pode ser visto, essa afinidade eletrônica é fortemente negativa, mesmo que o íon ou2- Possui a configuração eletrônica de néon (um gás nobre) e de ser um íon muito comum em muitos sólidos iônicos.
O motivo é que a repulsão de cargas negativas no ou2- desestabiliza esse íon estatal gasoso, mas no estado sólido a carga é estabilizada pelos cátions que o cercam.

