Regra de Markovnikov
- 754
- 40
- Gilbert Franecki
Qual é a regra de Markovnikov?
O Regra de Markovnikov É uma regra empírica, formulada em 1869 pelo químico russo Vladimir Markovnikov, que é usado para prever a regioselectividade dos produtos de uma adição eletrofílica. Ainda hoje ainda está em vigor, revelando sua simplicidade em como vem o mecanismo de várias reações orgânicas.
Esta regra se aplica especialmente aos alcenos em suas reações de hidrohalogenação. Assim, permite prever quais serão os produtos majoritários quando alcenos e alcinos reagirem com HX (HF, HCl, HBR e HI).
 Apreciação da regra de Markovnikov na hidro -halogenação do proponente. Fonte: V8rik, CC BY-SA 3.0, via Wikimedia Commons
Apreciação da regra de Markovnikov na hidro -halogenação do proponente. Fonte: V8rik, CC BY-SA 3.0, via Wikimedia Commons Suponha que, por exemplo. A regra de Markovnikov prevê que o produto majoritário será aquele em que o átomo de bromo está ligado ao carbono do centro; Enquanto estiver no produto menor, o bromo acaba com o carbono de ligação dupla.
Observe que o produto majoritário tem o átomo de hidrogênio ligado ao carbono terminal. Este último ponto é o mais fácil de memorizar: o hidrogênio HX vai para o carbono da ligação dupla que possui mais ligações de hidrogênio ou C-H.
Princípios do Regra de Markovnikov
Adição eletrofílica
Para as ligações duplas de alcenos ou alcinas. O HX tem um átomo de elétron ruim, que é H, e um átomo rico em elétrons, que é x.
Portanto, o HX pode ser representado como Hδ+-Xδ-, sendo a região Hδ+ Susceptível para receber elétrons de, neste caso, a ligação dupla de um alceno, ocorrendo o ataque eletrofílico (veja a imagem abaixo).
Pode servir a você: ácido fenilacético: estrutura, propriedades, usos, efeitosEstabilidade de carbocação
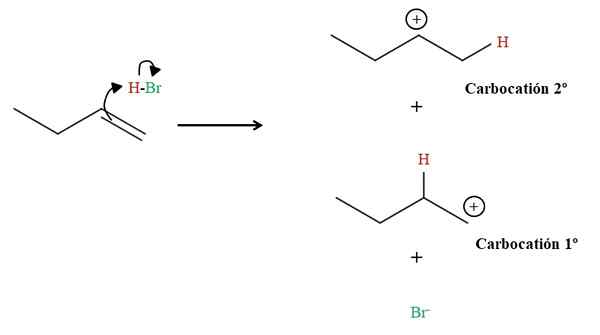
 Formação das duas carbocações na Hidrobromation de 1-Buteno. Fonte: Gabriel Bolívar via Molview.
Formação das duas carbocações na Hidrobromation de 1-Buteno. Fonte: Gabriel Bolívar via Molview. Como pode ser visto acima, a ligação dupla de 1-buteno ataca o hidrogênio da HBO. Ao fazer isso, os elétrons da ligação H-Br "aberta" em direção ao átomo de bromo, formando um carbocalização e o ânion BR-. No entanto, existe a possibilidade de formar duas carbocações: um primário (1º) e o outro secundário (2º).
Cada carbocalização é um composto intermediário do qual o produto final derivará. Quando houver duas carbocações, teremos dois produtos: 2-bromobutano e 1-bromobutano. O Br- Atua como um nucleófilo atacando qualquer um dos dois carbocações:
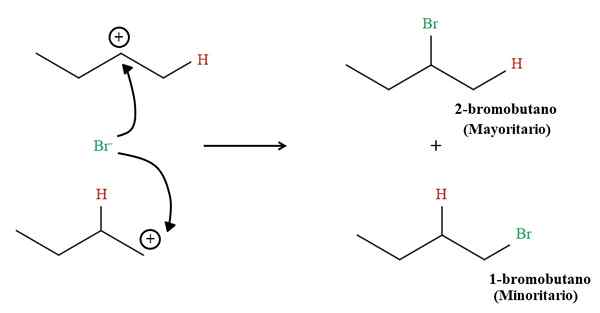 Produtos de hidrobromação de 1-buteno. Fonte: Gabriel Bolívar via Molview.
Produtos de hidrobromação de 1-buteno. Fonte: Gabriel Bolívar via Molview. Mas a proporção de ambos os produtos não é de 50%; O 2-bromobutano ocorre muito maior que o 1-bromobutano.
O motivo é que o segundo carbocalização é mais estável que o 1º carbocalização, uma vez que sua carga positiva é melhor estabilizada por átomos de carbono adjacentes; Enquanto estiver no carbocalização 1, o átomo de hidrogênio não contribui com quase nenhuma densidade eletrônica para essa carga positiva (seja para indução ou hiperconjugação).
Os ricos ficam mais ricos
O governo de Markovnikov nasceu das observações finais e deles os mecanismos ilustrados acima podem ser considerados para explicá -los.
Sem a necessidade de sempre capturar esses mecanismos ou deduzir a estabilidade das carbocações intermediárias, a regra simples é usada: em uma adição eletrofílica, os átomos de hidrogênio são direcionados para o carbono duplo com o duplo com mais átomos de hidrogênio. Assim, o carbono mais hidrogenado se torna ainda mais hidrogenado.
Pode atendê -lo: o que são anomalias de água?Por outro lado, o Atom X, neste caso o BR, termina no carbono da ligação dupla que possui mais ligações C-C, ou que é mais substituído por outros átomos que não são hidrogênio. Porque no 1-buteno seu carbono terminal é = CHO2, Este é o que recebe hidrogênio para se transformar no grupo -ch3.
Exemplos
O caso da regra de Markovnikov aplicado na reação de hidrobromation foi visto acima. Também é válido para reações de hidrocloclinação, hidroiodação, hidroaminação e hidratação, para alcenos ou alcinos.
Na seção seguinte, alguns exemplos adicionais serão vistos como exercícios.
Exercícios resolvidos
Exercício 1
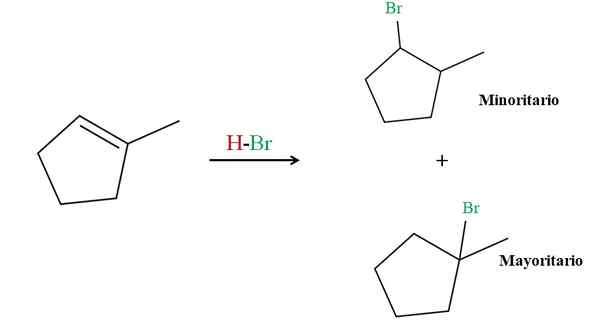 Hidrobromação do 2-metilciclopenteno. Fonte: Gabriel Bolívar via Molview.
Hidrobromação do 2-metilciclopenteno. Fonte: Gabriel Bolívar via Molview. A regra de Markovnikov diz que o HBr H para a reação superior deve ir para o carbono de ligação dupla com mais átomos de hidrogênio. Nesse caso, corresponde ao carbono acima, já que o carbono à direita, ligado a CHO3, Nem sequer tem átomos de hidrogênio.
Assim, o hidrogênio HBR vai para o carbono acima, enquanto o BR acaba ligado ao carbono à direita (produto majoritário). Por outro lado, se o hidrogênio estiver ligado ao carbono à direita, o BR é direcionado ao carbono acima (produto menor).
Observe que o produto majoritário consiste em um terceiro halogeneto, mais estável por definição e efeitos de estabilização de cargas positivas parciais; Enquanto o produto minoritário é o segundo e menos halogeneidade estável.
Ambos os produtos, a maioria e o menor. Esse tipo de produto minoritário, contra a regra de Markovnikov, é conhecido como produto antimarkovnikov.
Pode servir a você: Referência Eletrodo: Características, Função, ExemplosExercício 2
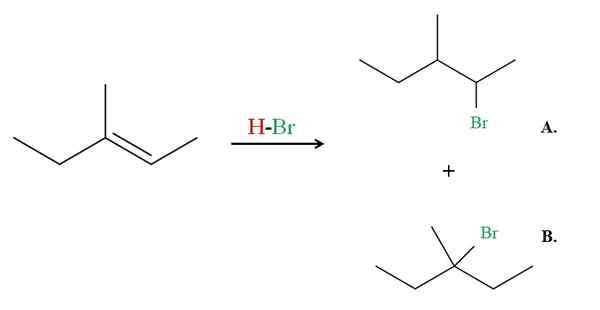 Hidrobromação de 3-metil-2-penteno. Fonte: Gabriel Bolívar via Molview.
Hidrobromação de 3-metil-2-penteno. Fonte: Gabriel Bolívar via Molview. Agora veja o exemplo do 3-metil-2-pentene.
Se observado, o carbono certo da ligação dupla tem um h, enquanto o da esquerda. Portanto, o H do HBR irá para esse carbono, o carbono deve ir ao centro para causar o produto B. O produto B é a maioria, porque novamente é um 3º halogeneto, sendo o produto um 2º Haluro.
Exercício 3
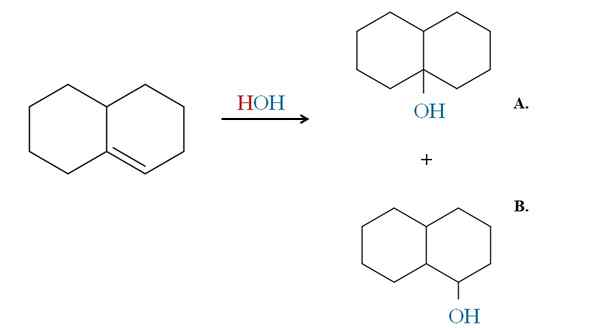 Exemplo da regra de Markovnikov na hidratação de um alceno cíclico. Fonte: Gabriel Bolívar via Molview.
Exemplo da regra de Markovnikov na hidratação de um alceno cíclico. Fonte: Gabriel Bolívar via Molview. Os exemplos anteriores teriam gerado os mesmos produtos se, em vez de HBR, fosse usado HCl e oi. O mesmo é o mesmo que com H2O em uma reação de hidratação catalisada por ácido e calor. Oh vem para substituir o átomo HX.
Portanto, a regra de Markovnikov nos diz que na adição eletrofílica acima, oh irá para o carbono da ligação dupla mais substituída, com menos hidrogênio.
Assim, o produto A é a maioria e o produto B a minoria. Observe novamente que o produto A é um terceiro álcool e o produto B a 2º álcool.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Regra de Markovnikov. Recuperado de: em.Wikipedia.org
- Steven a. Hardinger. (2017). Glossário ilustrado da química orgânica: Regra de Markovnikov. Recuperado de: química.UCLA.Edu
- Gamini Gunawardena. (24 de agosto de 2020). Regra de Markovnikov. Química Librettexts. Recuperado de: química.Librettexts.org
- Os editores da Enyclopaedia Britannica. (17 de setembro de 2013). Regra de Markovnikov. Recuperado de: Britannica.com
- Dr. S. Gevorg. (2020). Química Orgânica: Regra de Markovnikov com problemas de prática. Recuperado de: Chemistroysteps.com

