Calor de combustão

- 4345
- 1319
- Terrell Stokes
Qual é o calor da combustão?
Ele Calor de combustão É a energia liberada quando uma certa quantidade de material, geralmente um mol, reage exotermicamente com o oxigênio do ar. É uma propriedade de termoquímica essencial na caracterização de combustíveis, álcoois e, especialmente, hidrocarbonetos, como butano e metano.
Quando uma substância queima luz e calor, energia que pode ser usada para trabalhar em outros corpos. Por exemplo, o calor gerado é capaz de aquecer grandes volumes de água, cujo vapor pressiona o ambiente, agindo alguns geradores elétricos; ou simplesmente, mais alimentos aquecidos no vapor.
 O calor gerado pela combustão do gás da cozinha é usado para aquecer os caldeirões e os alimentos
O calor gerado pela combustão do gás da cozinha é usado para aquecer os caldeirões e os alimentos O calor da combustão varia entre todas as substâncias, embora sua natureza química seja essencial. Essa variação corresponde à estabilidade relativa, ou seja: quanto mais instável um composto, maior a energia liberada, representada como -ΔH. O símbolo negativo significa que o calor flui.
Diferentes valores de -ΔH são usados para comparar a estabilidade relativa entre diferentes alkaus e seus isômeros. Também permite que seja estável.
Medição
Para medir aquecimentos de combustão, é necessária uma bomba calorimétrica. Dentro dela, a substância está reagindo com oxigênio pela ativação de uma faísca elétrica.
Em seguida, o calor liberado aquece um volume de água que circunda o compartimento da amostra, medindo a temperatura antes e depois da combustão, bem como a massa de água e combustível.
Então, a energia liberada será igual a:
Ceh2o·mH2Ou · Δt
Ondeeh2o É o calor específico da água, 4.184 J/G · ºC, mH2Ou a massa da água, e Δt sua mudança de temperatura. Finalmente, esse calor, expresso em unidades de joule ou calorias, é dividido entre a massa ou as moles do combustível colocado dentro da bomba calorimétrica, para obter o calor da combustão por unidade de massa ou moles.
Pode atendê -lo: qual é o equivalente mecânico do calor?Os metais não se combinam, mas oxidam em velocidades diferentes, dependendo da temperatura em que são expostos. O calor que eles produzem é desprezível para serem medidos da mesma maneira que é feito com hidrocarbonetos e outros combustíveis. Eles não são, portanto, substâncias combustíveis.
Energias potenciais
Durante a combustão, os links são quebrados para formar novos, mais estáveis. A energia contida em todos os links de molécula é independente de seu movimento, então existe uma energia potencial.
Quanto maior a energia potencial, mais instável será a molécula e, portanto, liberará mais calor assim que os novos links forem estabelecidos.
Para saber quais são exatamente esses novos links, os produtos de uma combustão completa devem ser considerados: CO2 Para carbono, h2Ou para hidrogênio, e não2 Para nitrogênio. No que diz respeito aos hidrocarbonetos, sua combustão completa gerará misturas estequiométricas de CO2 e h2QUALQUER.
Ambas as moléculas, CO2 e h2Ou, eles têm energias de potencial muito baixo, porque seus links (O = C = O e H-O-H) são muito estáveis em comparação com os links de hidrocarbonetos dos quais vieram (C-H e C-C).
Estabilidade relativa
As energias potenciais são livremente. Mas suas variações não são, ou seja, a diferença dessas energias entre os produtos (co2 e h2O) e reagentes (hidrocarbonetos).
É por isso que ter essas variações, ou o que é o mesmo, sua combustão aquece, você pode saber quais são a estabilidade relativa entre um conjunto de hidrocarbonetos ou isômeros.
Fecha
Os alcaneos podem ser lineares, ramificados ou cíclicos. No caso de alcanos lineares, seu calor de combustão varia dependendo do comprimento de suas correntes; isto é, depende de quantas unidades CH2 ter. Considere o exemplo de n-hexano, n-heptano e n-octano:
Pode atendê -lo: iodo: história, propriedades, estrutura, obtenção, risco, usosCH3(CH2)4CH3, -ΔH = 4163 kJ/mol
CH3(CH2)5CH3, -ΔH = 4817 KJ/mol
CH3(CH2)6CH3, -ΔH = 5471 KJ/mol
Você pode ver que suas aquecimentos de combustão variam de 654 kJ/mol. Isso significa que todo Cho2 que é adicionado à corrente aumenta o calor da combustão a uma taxa de 654 kJ/mol. Assim, o Nonano, CH3(CH2)7CH3, Ele terá um calor de combustão igual a 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
É o mesmo que dizer que cadeias mais longas têm maiores energias em potencial e, portanto, elas são mais instáveis.
Os alcaneos ramificados são mais estáveis que lineares, e isso é deduzido de seus aquecimentos de combustão. Considere agora o caso de três isômeros do octano:
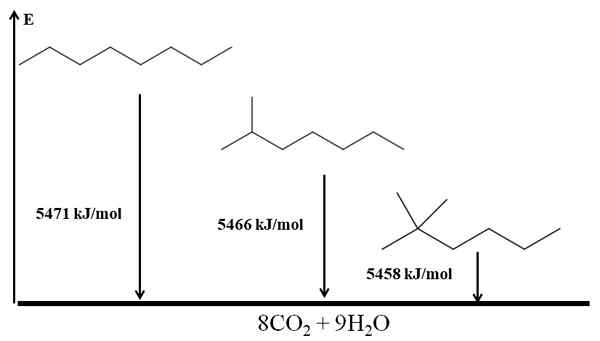 Combustão aquece para três isômeros de octane. Fonte: Gabriel Bolívar via Molview.
Combustão aquece para três isômeros de octane. Fonte: Gabriel Bolívar via Molview. Ele n-Octano é o mais instável porque seu calor de combustão é o maior (5471 kJ/mol). Por outro lado, os isômeros 2-metilheptono e 2.2-dimetilhexan. O 2.2-dimetilhexano é o mais estável por ser o mais ramificado dos três isômeros.
Alcenos
A estabilidade relativa dos alcenos também pode ser obtida de suas aquecimentos de combustão. Considere, por exemplo, quatro isômeros de Butenus:
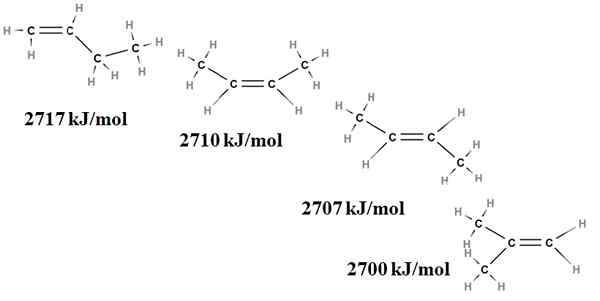 Combustão aquece para isômeros buteno. Fonte: Gabriel Bolívar via Molview.
Combustão aquece para isômeros buteno. Fonte: Gabriel Bolívar via Molview. Aqui não falamos mais sobre ramificações, mas sobre o grau de substituição da ligação dupla, c = c e suas tensões de van der Waals; isto é, de repulsões eletrônicas e estéricas entre dois grupos volumosos localizados no mesmo lado da ligação dupla.
O primeiro isômero, 1-buteno, é o mais instável porque sua ligação dupla é menos substituída (h2C = c). Isso se reflete em seu calor de combustão de 2717 kJ/mol.
Pode atendê -lo: ácido clorogênicoÀ direita, o cis-2-butene é um pouco mais estável porque sua ligação dupla é mais substituída. Mas o trans-2-buteno é ainda mais, porque mesmo que tenha o mesmo grau de substituição, os grupos Choons3 da ligação dupla estão em posições trans, isto é, em lados diferentes da ligação dupla. Observe que o calor do trans-2-buteno (2707 kJ/mol) é quase um pouco menor que o do cis-2-buteno (2710 kJ/mol).
O último isômero, o 2-metil-2-buteno, que também é igualmente substituído como cis e trans 2 bungeo, é o mais instável de todos. Isso é porque ambos chem3 Eles são encontrados em um dos carbonos da ligação dupla, portanto, sendo um alceno com Cho3 Gêmeos.
Compostos carbonil
Assim como os alcos e outros hidrocarbonetos em geral, a estabilidade relativa dos compostos carbonil (cetonas, aldeídos, ácidos carboxílicos) também estão relacionados aos seus aquecimentos de combustão.
Assim, quanto mais estabilizado, ou menos reativo, seus grupos C = O, os menores serão seus aquecimentos de combustão.
Por exemplo, o calor da combustão do butanal, ch3CH2CH2Cho, é 2475 kJ/mol. Este calor é maior que o 2-butanona, ch3CH2Coch3, que é igual a 2442 kJ/mol. Portanto, butanal é mais instável que 2-butanona.
No 2-butanona, o C = O é mais estabilizado graças aos grupos CH3CH2 e cap3; Coisa que não acontece com o butan, onde um dos grupos é quase um átomo h.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Calor de combustão. Recuperado de: em.Wikipedia.org
- Fundação CK-12. Calor de combustão. Química Librettexts. Recuperado de: química.Librettexts.org
- BBC. (2020). Energia química: entalpia de combustão. Recuperado de: BBC.co.Reino Unido
- Steven a. Hardinger. (2017). Glossário ilustrado da química orgânica: entalpia da combustão. Recuperado de: química.UCLA.Edu

