Características de reações químicas, peças, tipos, exemplos

- 2512
- 147
- Mr. Reginald Lindgren
As reações químicas São mudanças que sofrem na ordem de seus átomos e ocorrem quando duas substâncias ou compostos diferentes entram em contato. No processo, as mudanças que podem ser percebidas imediatamente; como um aumento de temperatura, resfriamento, formação de gás, flashes ou precipitação de um sólido.
As reações químicas mais comuns geralmente passam despercebidas na vida cotidiana; Milhares deles são realizados em nossos corpos. Outros, no entanto, são mais visíveis, porque podemos executá -los na cozinha selecionando utensílios e ingredientes corretos; Por exemplo, misture o bicarbonato com vinagre, açúcar de fusão na água ou acidifique o suco de colorad.
 A reação de bicarbonato e vinagre é um exemplo de reação química recorrente na cozinha. Fonte: Kate Ter Har (https: // www.Flickr.com/fotos/katerha/5703151566)
A reação de bicarbonato e vinagre é um exemplo de reação química recorrente na cozinha. Fonte: Kate Ter Har (https: // www.Flickr.com/fotos/katerha/5703151566) Nos laboratórios, as reações químicas se tornam mais usuais e comuns; Todos ocorrem dentro de copos (copos), ou frascos de Erlenmeyer. Se eles compartilham em comum, nenhum é simples, porque esconde colisões, links quebram, mecanismos, formação de links, energia e aspectos cinéticos.
Existem reações químicas tão impressionantes que fãs e cientistas, conhecendo a toxicologia dos reagentes e algumas medidas de segurança, reproduzem -os em grandes escalas em atos de demonstração fascinante.
[TOC]
Conceito de reação química
As reações químicas ocorrem quando há a quebra de um link (iônico ou covalente), para que outro seja formado no lugar; Dois átomos ou um conjunto deles param de interagir fortemente para causar novas moléculas. Graças a isso, as propriedades químicas de um composto, sua reatividade, estabilidade, com o que ele reage pode ser determinado.
Além de serem responsáveis as reações químicas que o assunto transforma constantemente, sem seus átomos, eles explicam o surgimento dos compostos como nós os conhecemos.
Para que os links sejam quebrados, a energia é necessária e, quando os links são formados, ela é liberada. Se a energia absorvida for maior que a liberada, diz -se que a reação é endotérmica; Temos um resfriamento circundante. Embora se o calor liberado for superior ao absorvente, será uma reação exotérmica; Os arredores estão aquecidos.
Características de reações químicas
Cinética
As moléculas da teoria devem colaborar entre si, carregando com eles energia cinética suficiente para favorecer a quebra de um link. Se suas colisões forem lentas ou ineficientes, a reação química será cineticamente afetada. Isso pode acontecer pelos estados físicos das substâncias, ou pela geometria ou estrutura do mesmo.
Assim, em uma reação, a matéria é transformada pela absorção ou liberação de calor, enquanto sofre colisões que favorecem a formação de produtos; Os componentes mais importantes de qualquer reação química.
Conservação em massa
Devido à lei de conservação em massa, a massa total do conjunto permanece constante após uma reação química. Assim, a soma das massas individuais de cada substância é igual à massa do resultado obtida.
Mudanças físicas e/ou estado
A ocorrência de uma reação química pode ser acompanhada por uma mudança de estado dos componentes; isto é, uma variação no estado sólido, líquido ou gasoso do material.
No entanto, nem todas as mudanças no estado implicam uma reação química. Por exemplo: se a água evapora devido ao calor, o vapor de água produzido após essa mudança de estado permanecer água.
Variação de cor
Entre os atributos físicos que resultam de uma reação química, a mudança na cor dos reagentes versus a cor do produto final se destaca.
Esse fenômeno é apreciável ao observar a reação química de metais com oxigênio: quando um metal é oxidado, muda sua cor característica (ouro ou prata, conforme o caso), para se tornar um tom de vermelho laranja, conhecido como ferrugem.
Liberação de gás
Essa característica se manifesta como um borbulhante ou com a emissão de odores particulares.
Geralmente, as bolhas aparecem como resultado da submissão de um líquido em altas temperaturas, o que incentiva um aumento na energia cinética das moléculas que fazem parte da reação.
Mudanças de temperatura
No caso de o calor ser um catalisador da reação química, uma mudança de temperatura será induzida no produto final. Portanto, a entrada de calor e a saída no processo também podem ser uma característica das reações químicas.
Partes de uma reação química
Reagentes e produtos
Uma reação química é representada por uma equação do tipo:
A + B → C + D
Onde A e B são os reagentes, enquanto C e D os produtos. A equação nos diz que o átomo ou molécula a reage com B para causar produtos C e D. Esta é uma reação irreversível, uma vez que os reagentes não podem se originar dos produtos. Em vez disso, a reação abaixo é reversível:
A + B C + D
É importante enfatizar que a massa dos reagentes (a+b) deve ser igual à massa dos produtos (C+D). Caso contrário, a massa não seria preservada. Da mesma forma, o número de átomos para um determinado elemento deve ser o mesmo antes e depois da seta.
Acima da seta indica algumas especificações da reação: a temperatura (δ), a incidência de radiação ultravioleta (Hv), ou o catalisador usado.
Pode atendê -lo: vidro do relógioReação significa
No que diz respeito à vida e às reações que ocorrem em nossos corpos, o meio de reação é aquoso (CA). No entanto, as reações químicas podem ser desenvolvidas em qualquer meio líquido (etanol, ácido acético glacial, tolueno, tetra -hidrofurano, etc.) desde que os reagentes sejam bem dissolvidos.
Recipientes ou reatores
Reações químicas controladas ocorrem em um recipiente, seja um material de vidro simples ou em um reator de aço inoxidável.
Tipos de reações químicas
Os tipos de reações químicas são baseadas no que acontece no nível molecular; O que os links quebram e como os átomos acabam se juntando. Também é levado em consideração se as espécies ganham ou perdem elétrons; mesmo quando isso ocorre na maioria das reações químicas.
Aqui estão os diferentes tipos de reações químicas que existem.
- Redução de oxidação (Rédox)
Oxidação de cobre
No exemplo da pátina, ocorre uma reação de oxidação: o cobre metálico perde elétrons na presença de oxigênio para se transformar em seu óxido correspondente.
4CU (s) + O2(g) => cu2Você)
O óxido de cobre (i) continua a oxidar para dar óxido de cobre (ii):
2CU2Ou (s) + ou2 => 4CUO (s)
Esse tipo de reação química em que as espécies aumentam ou reduzem seu número de oxidação (ou status), é conhecido como reação de oxidação e redução (Rédox).
O cobre metálico com o estado de oxidação 0 perde um elétron e depois o segundo (oxida), enquanto o oxigênio permanece (é reduzido):
Cu => Cu+ + e-
Cu+ => Cu2+ + e-
QUALQUER2 + 2e- => 2º2-
O ganho ou perda de elétrons pode ser determinado calculando números de oxidação para átomos nas fórmulas químicas de seus compostos resultantes.
Para Cu2Ou, sabe -se que, por ser um óxido, tem ânion ou2-, Portanto, para manter as cargas neutralizadas, cada um dos dois átomos de cobre deve ter +1 de carga. Muito semelhante ocorre com Cuo.
O cobre quando oxidado adquire números de oxidação positiva; e oxigênio, a ser reduzido, números de oxidação negativa.
Ferro e cobalto
Exemplos adicionais para reações são mostrados abaixo. Da mesma forma, um breve comentário será feito e as alterações nos números de oxidação serão especificadas.
FECL2 + Cocl3 => Fecl3 + Cocl2
Se os números de oxidação forem calculados, será observado que os do CL permanecerão com um valor constante de -1; Não é assim, com os de fé e companhia.
À primeira vista, o ferro oxidado enquanto o cobalto foi reduzido. Como saber? Porque o ferro interage agora não com dois cl- Mas com três, sendo o átomo de cloro mais eletronegativo do que o ferro e o cobalto. Por outro lado, o oposto acontece com o cobalto: vai de interagir com três cl- para dois deles.
Se o raciocínio anterior não estiver claro, as equações químicas da transferência líquida de elétrons serão escritas:
Fé2+ => Fé3+ + e-
Co3+ + e- => Co2+
Portanto, fé2+ Ele oxida, enquanto o CO3+ se reduz.
Iodo e manganês
6kmno4 + 5ki + 18hcl => 6mncl2 + 5kio3 + 6kCl+ 9h2QUALQUER
O produto químico acima pode parecer complicado, mas não é. O cloro (CL-) não o oxigênio (ou2-) Experimente ganho ou perda de seus elétrons. Iodo e manganês sim.
Considerando apenas compostos com iodo e manganês que você tem:
Ki => kio3 (Número de oxidação: -1 a +5, perde seis elétrons)
Kmno4 => Mcl2 (Número de oxidação: +7 a +2, ganha cinco elétrons)
O iodo oxida, enquanto o manganês é reduzido. Como saber sem calcular? Porque o iodo passa de estar com potássio para interagir com três oxigênio (mais eletronegativo); E o manganês, enquanto isso, perde interações com o oxigênio para estar com cloro (menos eletronegativo).
O KI não pode perder seis elétrons se o KMNO4 Ganhar cinco; É por isso que o número de elétrons deve ser equilibrado na equação:
5 (ki => kio3 + 6e-)
6 (KMNO4 + 5e- => Mcl2)
Que dá origem a uma transferência líquida de 30 elétrons.
Combustão
A combustão é uma oxidação vigorosa e energética na qual a luz e o calor são liberados. Geralmente, nesse tipo de reação química, o oxigênio participa como um agente oxidante ou combinado; Enquanto o agente redutor é o combustível, que queima no final da conta.
Onde há cinzas, houve combustão. Estes são compostos de óxidos de carvão e metal; Embora sua composição dependa logicamente de qual era o combustível. Abaixo estão alguns exemplos:
C (s) + O2(g) => CO2(g)
2CO (G) + ou2(g) => 2CO2(g)
C3H8(g) + 5o2(g) => 3Co2(g) + 4h2O (G)
Cada uma dessas equações corresponde a combinações completas; isto é, todo o combustível reage com um excesso de oxigênio para garantir sua transformação completa.
Deve -se notar também que o CO2 e h2Ou são produtos majoritários gasosos quando corpos carbonatados queimam (como madeira, hidrocarbonetos e tecidos de animais). É inevitável que algum carvão seja formado, devido a uma insuficiência de oxigênio, bem como a menos gases oxigenados como CO e não.
- Síntese
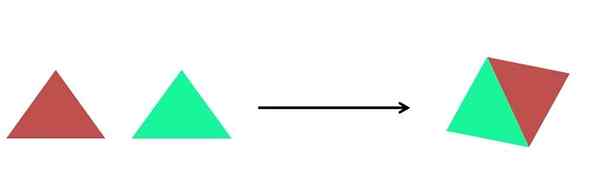
 Representação gráfica de uma reação de síntese. Fonte: Gabriel Bolívar.
Representação gráfica de uma reação de síntese. Fonte: Gabriel Bolívar. Na imagem superior, uma representação muito simples é mostrada. Cada triângulo é um composto ou átomo, que se reúne para formar um único composto; Dois triângulos formam um paralelograma. As massas aumentam e as propriedades físicas e químicas do produto são, geralmente, muito diferentes das de seus reagentes.
Pode servir você: entalpiaPor exemplo, a combustão de hidrogênio (que também é uma reação de rétox) produz óxido de hidrogênio ou hidreto de oxigênio; mais conhecido como Agua:
H2(g) + ou2(g) => 2h2O (G)
Ao misturar os dois gases, a alta temperatura, a produção de água gasosa que produzia. Temperaturas resfriadas, vapores condensam para dar água líquida. Vários autores consideram essa reação de síntese como uma das alternativas possíveis para substituir os combustíveis fósseis na obtenção de energia.
Os links H-H e O = O são quebrados para formar dois novos links simples: H-O-H. A água, como é bem conhecida, é uma substância incomparável (além do sentido romântico), e suas propriedades diferem bastante do hidrogênio e oxigênio gasosos.
Compostos iónicos
A formação de compostos iônicos de seus elementos também é um exemplo de reação de síntese. Um dos mais simples é a formação de metal halgenuros dos grupos 1 e 2. Por exemplo, a síntese de brometo de cálcio:
CA (S) + BR2(L) => CABR2(S)
Uma equação geral para esse tipo de síntese é:
M (s) + x2 => Mx2(S)
Coordenação
Quando o composto formado envolve um átomo metálico na geometria eletrônica, diz -se que é um complexo. Nos complexos, os metais permanecem unidos ao ligante por ligações covalentes fracas e são formadas por reações de coordenação.
Por exemplo, você tem o complexo [CR (NH3)6]3+. Isso é formado quando crocação3+ está na presença de moléculas de amônia, NH3, que atuam como ligantes cromados:
Cr3+ + 6NH3 => [CR (NH3)6]3+
Abaixo está a coordenação resultante octaedro ao redor do Chrome Metal Center:
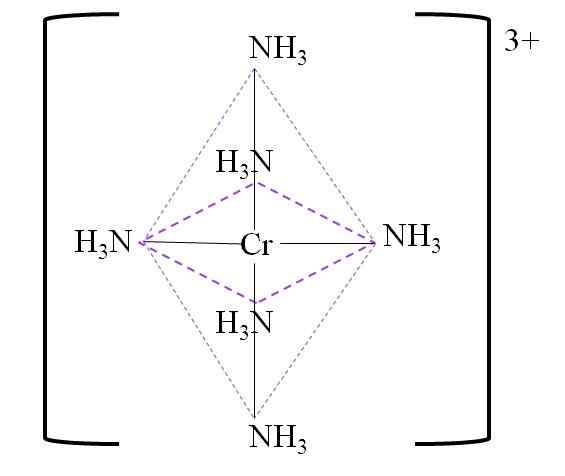 Coordenação octaedro para o complexo. Fonte: Gabriel Bolívar.
Coordenação octaedro para o complexo. Fonte: Gabriel Bolívar. Observe que a carga de cromo 3+ não é neutralizada no complexo. Sua cor é roxa, e é por isso que o octaedro é representado com a cor da referida cor.
Alguns complexos são mais interessantes, como no caso de certas enzimas que coordenam os átomos de ferro, zinco e cálcio.
- Decomposição
A decomposição se torna o oposto da síntese: um composto se divide em um, dois ou três elementos ou compostos.
Por exemplo, existem as três decomposições a seguir:
2HGO (S) => 2HG (L) + O2(g)
2h2QUALQUER2(L) => 2h2Ou (l) + o2(g)
H2Co3(AC) => CO2(g) + h2Ou (l)
HGO é um sólido avermelhado que, por ação de calor, quebra em metal mercúrio, líquido preto e oxigênio.
O hidrogênio peróxido de hidrogênio sofre decomposição, dando água líquida e oxigênio.
E ácido carbônico, enquanto isso, se decompõe em dióxido de carbono e água líquida.
Uma decomposição mais "seca" é a sofrida por carbonatos de metal:
Ladrão3(s) => cao (s) + co2(g)
Vulcão de classe
 Volcão de dicromato de amônio de mobília. Fonte: нататаnch [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Volcão de dicromato de amônio de mobília. Fonte: нататаnch [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Uma reação de decomposição que tem sido usada nas aulas de química é a decomposição térmica de dicromato de amônio (NH4)2Cr2QUALQUER7. Este sal carcanogenal laranja (por isso deve ser tratado com muito cuidado), queima para liberar muito calor e produzir um sólido verde, óxido crômico, CR2QUALQUER3:
(NH4)2Cr2QUALQUER7(s) => Cr2QUALQUER3(s) + 4h2Ou (g) + n2(g)
- Deslocamento
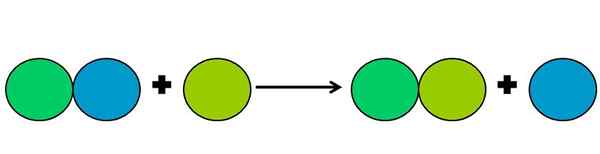 Representação gráfica de uma reação de deslocamento. Fonte: Gabriel Bolívar.
Representação gráfica de uma reação de deslocamento. Fonte: Gabriel Bolívar. As reações de deslocamento são um tipo de reação de reação no qual um elemento desloca outro em um composto. O elemento deslocado acaba reduzindo ou ganhando elétrons.
Para simplificar o acima, a imagem superior é mostrada. Círculos representam um elemento. Observa -se que o círculo verde de Lima desloca o azul, estando do lado de fora; Mas não apenas isso, mas o círculo azul é reduzido no processo, e o de Lima verde é oxidado.
De hidrogênio
Por exemplo, as seguintes equações químicas para expor as opções acima:
2al (s) + 6HCl (AC) => ALCL3(AC) + 3h2(g)
ZR (s) + 2h2Ou (g) => zro2(s) + 2h2(g)
Zn (s) + h2SW4(AC) => ZNSO4(AC) + H2(g)
Qual é o elemento deslocado para essas três reações químicas? Hidrogênio, que é reduzido a hidrogênio molecular, h2; passa de um número de oxidação de +1 para 0. Observe que os metais de alumínio, zircônio e zinco podem deslocar hidrogênios de ácidos e água; Enquanto cobre, prata ou ouro, não pode.
Metais e halogênio
Da mesma forma, essas duas reações de deslocamento adicionais estão disponíveis:
Zn (s) + CuO4(AC) => Cu (s) + ZNSO4(AC)
Cl2(g) + 2NAi (AC) => 2NACL (AC) + I2(S)
Na primeira reação, o zinco desloca o cobre de metal menos ativo; O zinco oxida enquanto o cobre é reduzido.
Na segunda reação, por outro lado, cloro, elemento mais reativo que iodo, desloca o último em sal de sódio. Aqui ocorre para trás: o elemento mais reativo é reduzido pela oxidação do elemento deslocado; Portanto, o cloro é reduzido oxidando em iodo.
- Formação de gás
Nas reações, pode -se observar que vários deles geraram gases e, portanto, eles também entram nesse tipo de reação química. Da mesma forma, as reações da seção anterior, o deslocamento de hidrogênio por um metal ativo, são consideradas reações de formação de gás.
Pode servir a você: Dodecil Sodium Sulfato (SDS): estrutura, propriedades, usosAlém dos já mencionados, os sulfetos de metal, por exemplo, liberam sulfeto de hidrogênio (que cheira a ovos podres) quando o ácido clorídrico é adicionado:
N / D2S (s) + 2HCl (AC) => 2NAcl (AC) + H2S (G)
- Metahesis ou deslocamento duplo
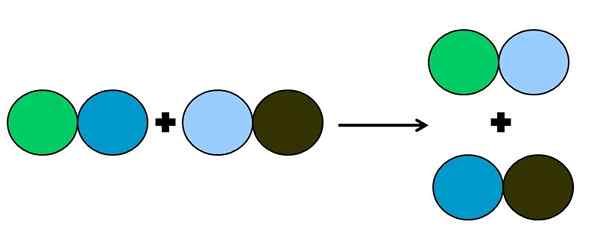 Representação gráfica de uma reação de deslocamento duplo. Fonte: Gabriel Bolívar.
Representação gráfica de uma reação de deslocamento duplo. Fonte: Gabriel Bolívar. Na reação de metátese ou deslocamento duplo, o que acontece é uma mudança de casais sem transferências de elétrons; isto é, não é considerado um rétox de reação. Como pode ser visto na imagem superior, o círculo verde quebra o link ao de azul escuro para vincular o círculo azul claro.
Precipitação
Quando as interações de um dos casais são fortes o suficiente para superar o efeito de solução de fluidos, um precipitado é obtido. As seguintes equações químicas representam reações de precipitação:
Agno3(AC) + NaCl (AC) => AgCl (s) + Nano3(AC)
CACL2(AC) + NA2Co3(AC) => caco3(S) + 2NAcl (AC)
Na primeira reação, o CL- desloca o não3- Para formar cloreto de prata, AgCl, que é um precipitado branco. E na segunda reação, o CO32- desloca o cl- Para precipitar carbonato de cálcio.
Ácido base
Talvez a mais emblemática das reações de metatanesia seja a do ácido da base de neutralização ácido. Finalmente, duas reações de ácido base são mostradas como exemplos:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Ou (l)
2HCl (AC) + BA (OH)2(AC) => BACL2(AC) + 2h2Ou (l)
OH- Eles se mudam para o CL- Para formar sais de água e cloreto.
Exemplos de reações químicas
Abaixo e depois haverá menção de algumas reações químicas com suas respectivas equações e comentários.
Deslocamento
Zn (s) + agno3(AC) → 2AG (s) + Zn (não3)2(AC)
O zinco desloca prata em seu sal de nitrato: reduz AG+ Um AG. Como resultado, o metal prata começa a precipitar no meio, observado em um microscópio que as árvores sem prata. Por outro lado, o nitrato é combinado com íons Zn2+ resultando para formar nitrato de zinco.
Neutralização
Ladrão3(S) + 2HCl (AC) → CACL2(AC) + H2Ou (L) + CO2(g)
O ácido clorídrico neutraliza o sal de carbonato de cálcio para produzir sal, cloreto de cálcio, água e dióxido de carbono. O co2 bolhas e é detectado na água. Este bubb3.
NH3(G) + HCl (G) → NH4Cl (s)
Nesta segunda reação, o HCL vaporiza a amônia gasosa. O cloreto de amônio salgado, NH4CL, é formado como uma fumaça esbranquiçada (imagem inferior), pois contém partículas muito finas suspensas no ar.
 Reação de treinamento de cloreto de amônio. Fonte: Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Reação de treinamento de cloreto de amônio. Fonte: Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Deslocamento duplo
Agno3(AC) + NaCl (AC) → AgCl (s) + nano3(AC)
Em uma reação de deslocamento duplo, há uma troca de "casais". Silver muda um casal com sódio. O resultado é que o novo sal, cloreto de prata, AGCL, precipita como um sólido leito.
RÉDOX
 Na reação química, latindo o calor do cão, o som e a luz azul são liberados. Fonte: Maxim Bilovitskiy via Wikipedia.
Na reação química, latindo o calor do cão, o som e a luz azul são liberados. Fonte: Maxim Bilovitskiy via Wikipedia. Existem inúmeras reações rédox. Um dos mais impressionantes é o de Barkin Dog:
8 n2Ou (g) + 4 cs2(L) → S8(S) + 4 CO2(g) + 8 n2(g)
A energia liberada é tanto quando os três produtos estáveis são formados, que um flash azulado (imagem superior) e um aumento retumbante na pressão causada pelos gases originados (CO2 e n2).
Além disso, tudo isso é acompanhado por um som muito forte semelhante ao latido de um cachorro. O enxofre produzido, S8, Cubra amarelo as paredes internas do tubo.
Qual espécie é reduzida e qual é oxidada? Como regra geral, os elementos têm o número de oxidação 0. Portanto, o enxofre e o nitrogênio em produtos devem ser as espécies que ganharam ou perdiam elétrons.
O enxofre oxidado (elétrons perdidos), pois tinha o número de oxidação -2 no CS2 (C4+S22-):
S2- → s0 + 2e-
Enquanto o nitrogênio foi reduzido (elétrons won), porque tinha o número de oxidação +1 em n2Ou (n2+QUALQUER2-):
2n+ + 2e → n0
Exercícios de reações químicas resolvidas
- Exercício 1
O que o sal precipita na próxima reação em meio aquoso?
N / D2S (AC) + Feso4(AC) →?
Como regra geral, todos os sulfetos, exceto para formados com metais alcalinos e amônios, precipitados em meio aquoso. Um deslocamento duplo ocorre: o ferro se liga ao sulfeto e sódio com sulfato:
N / D2S (AC) + Feso4(AC) → FES (s) + Na2SW4(AC)
- Exercício 2
Quais produtos teremos da seguinte reação?
Carimbo3)2 + CA (OH)2 →?
O hidróxido de cálcio não é muito solúvel em água; Mas a adição de nitrato de cobre ajuda a solubilizá -lo porque reage para formar seu hidróxido correspondente:
Carimbo3)2(AC) + CA (OH)2(AC) → Cu (OH)2(s) + CA (não3)2(AC)
O Cu (oh)2 É reconhecido instantaneamente por ser um precipitado azul.
- Exercício 3
Que sal ocorrerá na próxima reação de neutralização?
Al (oh)3(S) + 3HCl (AC) → ¿¿?
O hidróxido de alumínio se comporta como uma base reagindo com ácido clorídrico. Em uma reação de neutralização ácida-base (da água-amante de Brnsted), é sempre formada, o outro produto deve ser cloreto de alumínio, Alcl3:
Al (oh)3(S) + 3HCl (AC) → Alll3(AC) + 3h2QUALQUER
Desta vez, o Alcl3 Não precipita porque é um sal (até certo ponto) solúvel em água.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Ana Zita. (18 de novembro de 2019). Reações químicas. Recuperado de: Todamateria.com
- Kashyap Vyas. (23 de janeiro de 2018). 19 reações químicas legais que a ciência da Prov está falcinando. Recuperado de: InteressionEngineering.com
- BeautifulChemistry.rede (s.F.). Reação. Recuperado de: beautifulchemistry.líquido
- Wikipedia. (2019). Reação química. Recuperado de: em.Wikipedia.org

