Reações exotérmicas e endotérmicas
- 1983
- 464
- Ernesto Bruen
 A combustão é um exemplo de reação exotérmica, pois libera calor. Por sua vez, o gelo derrete através de uma reação endotérmica, pois requer energia térmica
A combustão é um exemplo de reação exotérmica, pois libera calor. Por sua vez, o gelo derrete através de uma reação endotérmica, pois requer energia térmica As reações exotérmicas e endotérmicas Eles diferem no fato de que a primeira liberação de energia térmica, enquanto estas a absorvem, de acordo com as mudanças de calor que ocorrem durante as reações químicas.
Da mesma forma, outros tipos de energia podem estar envolvidos em reações químicas, pois às vezes durante a reação, energia luminosa, energia sonora e até eletricidade são produzidos.
Para levar em consideração não apenas o calor, mas outros tipos de energia, as reações químicas são classificadas como Exerergônico e Endermanics. Uma reação exercitada libera energia quando produzida, enquanto um endegonico a absorve.
Nesse caso, uma reação exotérmica também é uma reação exercitada, pois libera calor. Um dos exemplos mais familiares é a combustão. Toda vez que um pedaço de madeira é queimado, energia calórica e brilhante é liberada.
Por outro.
Uma reação exotérmica pode ocorrer espontaneamente, embora às vezes você precise fazer algum trabalho para começar. No entanto, para que uma reação endotérmica ocorra, é sempre necessário que o meio ambiente faça um trabalho no sistema.
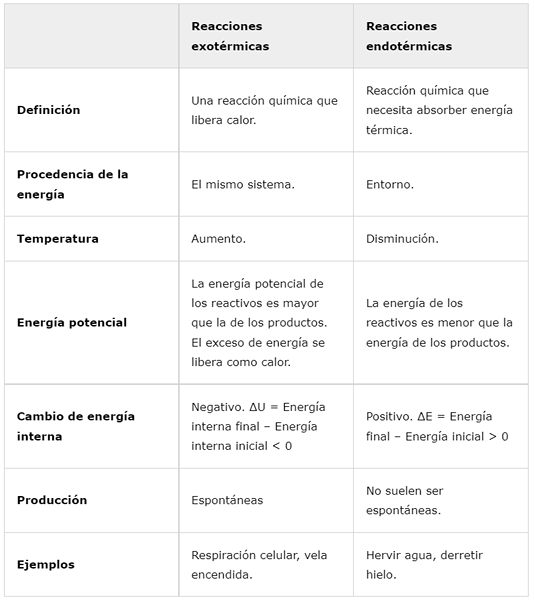
Reações exotérmicas | Reações endotérmicas | |
Definição | Uma reação química que libera calor. | Reação química que precisa absorver energia térmica. |
Origem da energia | O mesmo sistema. | Em volta. |
Temperatura | Aumentar. | Diminuir. |
Energia potencial | A energia potencial dos reagentes é maior que a dos produtos. Excesso de energia é liberado como calor. | A energia dos reagentes é menor que a energia dos produtos. |
Mudança de energia interna | Negativo. ΔU = energia interna final - energia interna inicial < 0 | Positivo. ΔE = energia final - energia inicial> 0 |
Produção | Espontâneo | Eles geralmente não são espontâneos. |
Exemplos | Respiração celular, vela ardente. | Ferver água, derreter gelo. |
Reações exotérmicas
Definição
Tipo de reação química que libera calor quando é realizado.
Pode atendê -lo: ciclohexeno: estrutura, propriedades, síntese e usosOrigem da energia
O mesmo sistema fornece energia para que a reação ocorra.
Temperatura
Após a reação, há um aumentar de temperatura.
Energia potencial
Quando ocorre uma reação química entre os reagentes, os links são quebrados entre eles e outros são formados para criar novas moléculas. Mas nem todos os links unem átomos e moléculas com a mesma força, portanto, energia para quebrar ou criar cada link é diferente.
Durante cada reação, eles quebram e criam um número diferente de links, então a energia é diferente. Em uma reação exotérmica, a energia potencial dos reagentes é maior do que o dos produtos e, como a energia é preservada, o excesso é liberado como calor.
Mudança de energia interna
A energia interna está relacionada à capacidade do sistema de executar o trabalho e inclui sua energia potencial e energia cinética. A energia absoluta do sistema não é determinada, mas sua variação chamada Δu.
De acordo com o que foi dito na seção anterior, a mudança de energia interna Δu é negativa.
ΔU = energia interna final - energia interna inicial < 0
Produção
A maioria das reações exotérmicas são espontâneo, isto é, eles ocorrem por si mesmos, sem a necessidade de adicionar energia externa, até que os reagentes estejam esgotados.
Exemplos
Normalmente, as reações de oxidação e aquelas que levam à formação de compostos são geralmente reações exotérmicas:
1. Dissolver detergente na água
Ao dissolver as roupas de pó em um pouco de água fria, ele se sente quente ao tocá -la.
2. Respiração celular
Em animais e plantas, o processo de respiração celular é realizado como parte do ciclo de carbono. A respiração usa glicose e oxigênio para devolver dióxido de carbono, água e energia, de acordo com a reação:
Pode atendê -lo: óxido de titânio (iv): estrutura, propriedades, usosC6H12QUALQUER6 + 6º2 → 6CO2 + H2O + Energia (ATP)
3. Uma vela ardente
Além da luz, uma vela ardente emite calor e outras substâncias:
Oxigênio oxigênio → água + dióxido de carbono + luz e calor
4. O besouro de bombardeio
Este inseto se defende borrifando um aerossol sobre seus predadores. O besouro mantém fluidos e enzimas em compartimentos separados, localizados em seu abdômen.
Quando ameaçado, expulsa os fluidos em direção ao compartimento enzimático e uma reação química que gera vapor e calor é produzida, agindo como repelente para possíveis predadores.
5. Lã de aço e vinagre
Um metal como o ferro é oxidado lentamente ao reagir com o ambiente, mas se o vinagre for adicionado a um pouco de lã de aço, observa -se que a oxidação é muito mais rápida e, ao mesmo tempo, gera calor.
Reações endotérmicas
Definição
Reações nas quais os reagentes precisam absorver energia térmica para que os produtos sejam obtidos.
Origem da energia
A energia necessária para que a reação seja realizada do meio ambiente.
Temperatura
A reação endotérmica implica um diminuir de temperatura.
Energia potencial
Ao contrário do que acontece com uma reação exotérmica, a energia dos reagentes É menor que a energia dos produtos.
Mudança de energia interna
Em uma reação endotérmica, a mudança de energia interna ΔE é positiva.
ΔE = energia final - energia inicial> 0
Portanto, a energia final é maior que a inicial.
Produção
As reações endotérmicas exigem que o trabalho no sistema seja realizado, para que geralmente não sejam espontâneos.
No entanto, existem algumas reações endotérmicas, como o derretimento do gelo e a evaporação de certos líquidos, que são espontâneos à temperatura ambiente.
Conclui -se então que a temperatura do ambiente é um fator determinante na espontaneidade de uma reação química.
Pode servir a você: Indicadores químicos: Para que servem, tipos, exemplosExemplos
Muitas das reações envolvendo sais de dissolução e, em geral, a decomposição de substâncias, são geralmente endotérmicas. Da mesma maneira, a passagem de gelo para água líquida e a água líquida a vapor, ou seja, as transformações do estado, também são reações endotérmicas.
1. Fotossíntese
As plantas realizam uma reação química na presença de luz solar, na qual convertem dióxido de carbono e água em glicose e oxigênio. A clorofila é a molécula chave nesse processo, cuja reação química é:
Luz + 6co2 + H2O → c6H12QUALQUER6 + 6º2
Como pode ser visto, é a reação inversa da respiração. Para produzir um quilograma de glicose, são necessários 15 mega joules de energia solar.
2. Ferva água e cozinhe
Uma reação muito comum, que requer energia para prosseguir, é a água fervente:
H2O (líquido) + energia → h2O (vapor)
Os alimentos normalmente requerem água para cozinhar e, da mesma maneira, a água que eles contêm deve evaporar para cozinhá -los, o que envolve uma mudança de estado.
3. Para derreter o gelo
Da mesma forma, é comum que o gelo derrete à temperatura ambiente, se isso for maior que 0 ° C:
H2O (sólido) + energia → h2O (líquido)
Portanto, a bebida esfria ao adicionar gelo, pois absorve a energia necessária para mudar o estado do líquido.
4. Sacos frios
Eles são usados para tratar hematomas e golpes. Contêm água e um envelope com cloreto de amônio. Ao tocar na bolsa, o envelope é quebrado e a reação do cloreto de amônio com água, que é endotérmica, esfria a bolsa e alivia a dor.
5. Produção de ozônio
A radiação ultravioleta do sol transforma oxigênio em ozônio, liberando calor no processo.
3º2 (gás) + luz ultravioleta → 2º3 (gás)
Referências
- Byju's. Diferença entre reações eduotérmicas e exotérmicas. Recuperado de Byjus.com
- Chang, R. (2013). Química. 11VA. Edição. Educação de McGraw Hill.
- Grelane. Reações exotérmicas para aquecer as coisas. Recuperado de: Grelane.com.
- Hein, m. (2014). Fundamentos da química da faculdade. Wiley.
- Helmestina, a. Entendendo reações endotérmicas e exotérmicas. Recuperado de: pensamento.com

