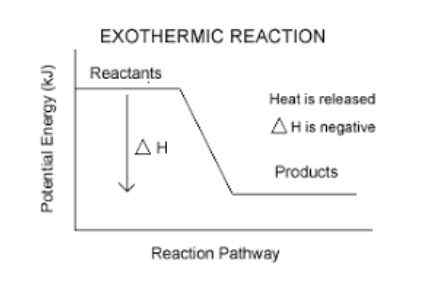
Reação exotérmica
- 2252
- 322
- Pete Wuckert
Explicamos o que são reações exotérmicas, suas características, diferenças com reações endotérmicas e dão vários exemplos
O que são reações exotérmicas?
As reações exotérmicas São reações químicas que liberam energia na forma de calor. A palavra exotérmica é formada por "EXO" o que significa "fora", e "Thermons" o que significa calor, então "reação exotérmica" significa literalmente, reação na qual o calor se apaga.
Essas reações são muito comuns e podemos encontrá -las em todos os lugares, de nossas casas às células que fazem parte do nosso corpo.
Em casa, podemos encontrá -los na cozinha quando o gás queima na buzina para cozinhar nossa comida. Também os encontramos dentro dos motores de carro quando queimam combustível.
 Um exemplo de reação exotérmica
Um exemplo de reação exotérmica Por outro lado, as reações exotérmicas são essenciais para a vida, pois fornecem às células a energia necessária para viver, crescer e reproduzir.
Características de reações exotérmicas
Eles liberam energia na forma de calor
Esta é a principal característica que os torna reações exotérmicas.
A energia liberada vem dos mesmos reagentes
Toda reação química requer alguma energia de ativação para ocorrer. No caso de reações exotérmicas, essa energia vem dos mesmos reagentes quando transformados em produtos.
Os produtos de reações exotérmicas são sempre mais estáveis que os reagentes.
Os reagentes se tornando produtos, perdem parte de sua energia na forma de calor. Por esse motivo, os produtos sempre permanecem com menos energia que os reagentes, o que os torna mais estáveis.
Eles têm uma variação de entalpia negativa.
Esta é uma maneira fácil de saber se uma reação é exotérmica ou não. Qualquer reação que tenha um ah (leia delta h) negativo, será exotérmico.
- Por exemplo, A reação de combustão do butano (o gás que queimamos na cozinha) tem uma variação de entalpia de -11.823 kcal/mol. Portanto, é uma reação exotérmica.
Eles só precisam de um gatilho para ocorrer na maioria dos casos.
Muitas reações exotérmicas precisam apenas de algo que lhes dê energia suficiente para começar. Depois disso, o mesmo calor que eles liberam é suficiente para manter a reação caminhando.
- Por exemplo, Ao queimar gás, apenas uma faísca é necessária, então a chama continua ligando até que o gás acabasse.
Diferenças entre reações exotérmicas e reações endotérmicas
As reações exotérmicas são o oposto das reações endotérmicas. Neste último, os reagentes absorvem energia na forma de calor em vez de liberá -lo, como em reações exotérmicas.
Em seguida, são apresentadas as principais diferenças entre reações exotérmicas e endotérmicas:
Reações exotérmicas | Reações endotérmicas |
Eles liberam energia na forma de calor. | Eles absorvem energia na forma de calor. |
Eles têm uma variação de entalpia negativa, ou seja, DH<0. | Eles têm uma variação de entalpia positiva, ou seja, dh> 0. |
Eles tendem a aumentar a temperatura circundante. | Eles tendem a reduzir a temperatura ou esfriar ao redor. |
A energia que mantém a caminhada da reação vem dos mesmos reagentes. | A energia que mantém a caminhada da reação vem do ambiente. |
Produtos mais estáveis são sempre obtidos com menos energia. | Produtos menos estáveis são sempre obtidos com um nível mais alto de energia. |
Exemplos de reações exotérmicas
A combustão de gás de cozinha
Na maioria das casas do mundo, o gás usado para cozinhar alimentos é butano, que tem a fórmula molecular C4H10. Este hidrocarboneto é queimado com o oxigênio do ar por meio da próxima reação de combustão, liberando grandes quantidades de calor:
Pode atendê -lo: microscópio simples
A explosão de dinamite
Dinamite contém um explosivo chamado nitroglicerina (c3H5N3QUALQUER9). Este composto decompõe -se muito violentamente que libera grandes quantidades de calor, o que causa uma grande explosão. A reação química é:
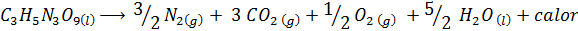
Esta reação tem um ΔH = -368 kcal⁄mol, Portanto, é uma reação exotérmica.
Combustão espontânea de fósforo branco
O elemento fósforo (P) pode ser encontrado como fósforo vermelho ou fósforo branco. Fósforo branco. A reação é:
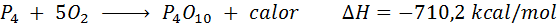
Respiração celular
A respiração celular é uma reação química exotérmica que consiste na oxidação dos alimentos que comemos. O calor liberado por esta reação é usado pelas células para realizar inúmeras reações químicas endotérmicas que exigem energia para ocorrer.
Os fogos artificiais
Os fogos de artifício contêm pólvora preta como o principal componente explosivo. A pólvora é uma mistura que contém nitrato de potássio, grafite e carbono de enxofre que reagem entre si através de uma reação exotérmica. O calor que essa reação libera, gera a ampla gama de cores que vemos no céu quando os fogos de artifício explodem.
A almofada térmica química
As almofadas térmicas são usadas como compressas quentes para aliviar as lesões esportivas. Estes consistem em um saco selado contendo água e um químico dentro de um pequeno tubo. Quando o tubo é quebrado, o químico é misturado com a água que produz uma reação química exotérmica que aquece o bloco.
Reação metálica de sódio com água
O sódio (NA) é um metal alcalino muito reativo que, ao entrar em contato com a água, reage violentamente liberando muito calor e hidrogênio gasoso. A reação é:
Pode servir a você: Métodos de separação de misturas heterogêneas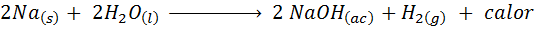
Esta reação libera 1900 calorias para cada grama de Na que reage com água. Isso significa que 1 grama de sódio seria suficiente para aquecer 3 xícaras de café médias.
Dissolução de detergente
Esta é uma reação que qualquer um pode experimentar em sua casa. Ao tomar um punhado de detergente em pó para lavar roupas e molhá -las com um pouco de água, a mão se sentirá imediatamente quente. Isso ocorre porque o processo de dissolução do detergente na água é exotérmico.
A reação de Trimita
O termita é uma mistura de alumínio na forma de um pó muito fino e um óxido de outro metal como ferro. Após uma faísca, a reação que ocorre é:
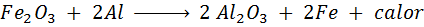
Essa reação libera muito calor, capaz de derreter ferro e é muito usado para soldar os trilhos.
Condensação de água
Para todas as substâncias, mudanças na fase gasosa (condensação), líquido a sólido (solidificação) e gás sólido (deposição), sempre liberam calor e, portanto, são processos exotérmicos. No caso da água, a condensação de apenas 18 gramas de água libera aproximadamente 10.000 calorias, o que é suficiente para aquecer 15 pequenas xícaras de café.
Referências
- Chang, R. e Goldsby, k. (2014). Química. 11ª ed. Nova York: Educação McGraw-Hill.
- Reação exotérmica (2020, 19 de dezembro). Na Wikipedia. Tirado de.Wikipedia.org
- Holmes, w. S. (1963). Calor de combustão de fósforo e entalpias de formação de p4o10 e h3po4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. a partir de um., F. Yo. (2014). Fogos de artifício, foguetes e muita química. Educação química. 44-51. Doi: 10.2436/20.2003.02.134
- Reação termite. Universidade de Minnesota (Departamento de Química). Retirado de Chem.Umn.Edu

