Propriedades periódicas dos elementos e suas características

- 1321
- 256
- Ralph Kohler
As Propriedades periódicas dos elementos São aqueles que definem seu comportamento físico e químico de uma perspectiva atômica e cujas magnitudes, além do número atômico, permitem uma classificação de átomos.
De todas as propriedades, elas são caracterizadas, como o nome indica, porque são periódicas; Ou seja, se a tabela periódica for estudada, pode -se certificar que suas magnitudes obedecem a uma tendência que coincide e repete com a ordem dos elementos em períodos (linhas) e grupos (colunas).
 Periodicidade intrínseca de uma parte dos elementos da tabela periódica. Fonte: Gabriel Bolívar.
Periodicidade intrínseca de uma parte dos elementos da tabela periódica. Fonte: Gabriel Bolívar. Por exemplo, se você viajar um período periódico e a propriedade diminuir com magnitude a cada elemento, o mesmo acontecerá em todos os períodos. Por outro lado, se descer um grupo ou coluna, aumenta sua magnitude, o mesmo pode ser esperado para os outros grupos.
E assim, suas variações são repetidas e evidenciadas uma tendência simples que concorda com a ordem dos elementos para seus números atômicos. Essas propriedades são diretamente responsáveis pela natureza metálica ou não metálica dos elementos, bem como por suas reatividades, o que ajudou a classificá -los com maior profundidade.
Se por um momento a identidade dos elementos fosse desconhecida e eles fossem vistos como "esferas" estranhos, a tabela periódica poderia ser reconstruída (com muito trabalho) fazendo uso dessas propriedades.
Dessa forma, as supostas esferas adquiririam cores que os permitiriam diferenciá -las um do outro em grupos (imagem superior). Conhecendo suas características eletrônicas, eles poderiam se organizar em períodos, e os grupos trairiam aqueles que têm o mesmo número de elétrons de valência.
As propriedades periódicas de aprendizado e raciocínio são iguais a saber por que os elementos reagem de uma maneira ou de outra; É saber por que os elementos metálicos estão em certas regiões da tabela e os elementos não -metálicos em outro.
[TOC]
Quais são as propriedades periódicas e suas características
-Rádio atômico
Ao observar a imagem, a primeira coisa que pode ser notada é que nem todos são do mesmo tamanho. Alguns são mais volumosos que outros. Se observado com mais detalhes, descobrirá -lo que esses tamanhos variam obedecendo a um padrão: em um período que diminui da esquerda para a direita e em um grupo aumenta de cima para baixo.
O exposto acima também pode ser dito dessa maneira: o raio atômico diminui em direção aos grupos ou colunas da direita e aumenta nos períodos ou linhas inferiores. Assim, o raio atômico é a primeira propriedade periódica, uma vez que suas variações seguem um padrão dentro dos elementos.
Carga nuclear vs elétrons
O que é esse padrão? Em um período, os elétrons atômicos ocupam o mesmo nível de energia, que está relacionado à distância que os separa do núcleo. Quando passamos de um grupo para outro (que é o mesmo que viajar para o período para a direita), o núcleo adiciona elétrons e prótons ao mesmo nível de energia.
Pode atendê -lo: carbonoPortanto, os elétrons não podem ocupar distâncias mais longe do núcleo, o que aumenta sua carga positiva porque tem mais prótons. Consequentemente, os elétrons experimentam uma força maior de atração pelo núcleo, atraindo -os cada vez mais à medida que o número de prótons aumenta.
É por isso que os elementos na extremidade direita da tabela periódica (colunas amarelos e turquesas) têm rádios atômicos menores.
Por outro lado, quando "salta" de um período para outro (que é o mesmo para dizer que um grupo é descendente), os novos níveis de energia habilitados permitem que os elétrons ocupem espaços mais distantes no núcleo. Sendo ainda mais, o núcleo (com mais prótons) os atrai com menos força; E rádios atômicos, portanto, aumentam.
Rádios iônicos
Os rádios iônicos obedecem a um padrão semelhante ao dos rádios atômicos; No entanto, estes não dependem tanto do núcleo, mas quantos elétrons ou menos tem o átomo em relação ao seu estado neutro.
Cátions (NA+, AC2+, Para o3+, Ser2+, Fé3+) exibem uma carga positiva porque perderam um ou mais elétrons e, portanto, o núcleo os atrai com maior força, pois há menos repulsões entre eles. O resultado: os cátions são menores que os átomos dos quais derivam.
E para ânions (ou2-, F-, S2-, Yo-) Pelo contrário, eles exibem carga negativa porque possui um ou mais elétrons em excesso, aumentando suas repulsões acima da atração que o núcleo exerce. O resultado: os ânions são maiores que os átomos dos quais derivam (imagem inferior).
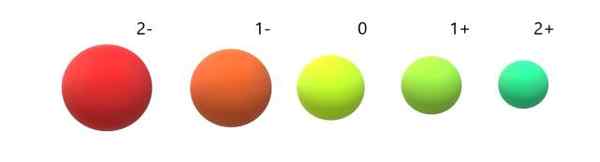 Variação de rádios iônicos em relação ao átomo neutro. Fonte: Gabriel Bolívar.
Variação de rádios iônicos em relação ao átomo neutro. Fonte: Gabriel Bolívar. Pode-se observar que o Anion 2- é o mais volumoso de todos, e o cátion 2+ o menor. Os rádios aumentam quando o átomo é carregado negativamente e se contrai quando é carregado positivamente.
-Eletro-negatividade
Quando os elementos têm pequenos rádios atômicos, não apenas seus elétrons são muito atraídos, mas também os elétrons dos átomos vizinhos quando formar uma ligação química. Essa tendência de atrair os elétrons de outros átomos dentro de um composto é o que é conhecido como eletronegatividade.
Aquele que um átomo é pequeno não significa que será mais eletronegativo. Nesse caso, os elementos de hélio e hidrogênio seriam os átomos mais eletronegativos. O hélio para onde a ciência demonstrou, não forma qualquer tipo de ligação covalente; E hidrogênio, mal tem um único próton no núcleo.
Pode atendê -lo: sulfeto de cobre: estrutura, propriedades, usosQuando os rádios atômicos são grandes, os núcleos não têm força suficiente para atrair os elétrons de outros átomos; Portanto, os elementos mais eletronegativos são aqueles com um pequeno raio atômico e um número maior de prótons.
Novamente, aqueles que atendem a essas características perfeitamente são os elementos não metálicos do bloco P da tabela periódica; Estes são aqueles pertencentes ao grupo 16 ou oxigênio (O, S, Se, TE, PO) e Grupo 17 ou Fluorine (F, Cl, Br, I, AT).
Tendência
Segundo tudo o que dizia, os elementos mais eletronegativos estão especialmente localizados no canto superior direito da tabela periódica; ter fluoreto como o elemento que lidera a lista dos mais eletronegativos.
Porque? Sem recorrer a escalas de eletronegatividade (Pauling, Mulliken, etc.), o fluor, embora seja maior que o neon (o gás nobre de seu período), o primeiro pode formar links enquanto o segundo não. Além disso, para seu tamanho pequeno, seu núcleo tem muitos prótons e onde está a fluor, haverá um momento dipolar.
-Caráter metálico
Se um elemento tem um raio atômico em comparação com o do mesmo período e também é pouco eletronegativo, é então um metal e tem um caráter metálico alto.
Se voltarmos à imagem principal, as esferas avermelhadas e esverdeadas, assim como o cinza, correspondem aos elementos de metal. Os metais têm características únicas e a partir daqui as propriedades periódicas com as propriedades físicas e macroscópicas da matéria começam a ser entrelaçadas.
Os elementos com um caráter metálico alto são caracterizados por seus átomos relativamente grandes, fáceis de perder elétrons, já que os núcleos mal podem atraí -los para eles.
Como resultado, eles oxidam ou perdem elétrons facilmente para formar cátions, M+; Isso não significa que todos os cátions sejam metálicos.
Tendência
Neste ponto, você pode prever como o caráter metálico na tabela periódica varia. Se souber que os metais têm grandes rádios de metal e que também existem poucos eletronegativos, os elementos mais pesados (períodos mais baixos) devem ser esperados, sejam os mais metálicos; e os elementos mais leves (os períodos superiores), os menos metálicos.
Da mesma forma, o caráter metálico diminui quanto mais eletronegativo o elemento é feito. Isso significa que visitar os períodos e grupos à direita da tabela periódica, em seus períodos mais altos, atenderá aos elementos menos metálicos.
Portanto, o caráter metálico aumenta descendo por um grupo e diminui para o direito ao direito no mesmo período. Entre os elementos metálicos que temos: Na (sódio), Li (lítio), Mg (magnésio), BA (bário), AG (prata), Au (ouro), PO (Polonio), Pb (chumbo), CD (cádmio ), Para (alumínio), etc.
Pode atendê -lo: ponto de ebulição: conceito, cálculo e exemplos-Energia de ionização
Se um átomo tiver um grande raio atômico, espera -se que seu núcleo não mantenha os elétrons em força considerável nas camadas mais externas. Consequentemente, eliminá -los do átomo em uma fase gasosa (individualizada) não exigirá muita energia; Isto é, energia de ionização, ei, necessária para tirar um elétron.
O também é igual a dizer que é a energia que deve ser fornecida para superar a força de atração do núcleo de um átomo ou íon gasoso em seu elétron mais externo. Quanto menor o átomo e mais eletronegativo, menor é o seu; Esta é a sua tendência.
A equação a seguir ilustra um exemplo:
Na (g) => na+(g) + e-
O necessário para conseguir isso não é tão grande em comparação com a segunda ionização:
N / D+(g) => na2+(g) + e-
Já que em Na+ As cargas positivas predominam e o íon é menor que o átomo neutro. Consequentemente, o núcleo de NA+ atrai com uma força muito maior para os elétrons, por isso requer um muito maior.
-Afinidade eletrônica
E, finalmente, há a propriedade periódica da afinidade eletrônica. Esta é a tendência energética que tem o átomo de um elemento de fase gasosa para aceitar um elétron. Se o átomo for pequeno e tiver um núcleo com uma grande força de atração, será fácil aceitar o elétron, formando um ânion estável.
Quanto mais estável o ânion em relação ao seu átomo neutro, maior sua afinidade eletrônica. No entanto, as repulsões entre os mesmos elétrons também entram em jogo.
O nitrogênio, por exemplo, tem maior afinidade eletrônica do que oxigênio. Isso ocorre porque seus três elétrons 2p desaparecem e repele menos entre si e com o elétron que entra; Enquanto estiver em oxigênio, há um par de elétrons emparelhados que exercem maior repulsão eletrônica; E no fluoreto, existem dois pares.
É por esse motivo que se diz que a tendência de afinidades eletrônicas é normalizada a partir do terceiro período da tabela periódica.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Prof. Ortega graciela m. (1 de abril de 2014). Propriedades periódicas dos elementos. Cor ABC. Recuperado de: ABC.com.Py
- Química Librettexts. (7 de junho de 2017). Propriedades do período dos elementos. Recuperado de: química.Librettexts.org
- Helmestine, Anne Marie, Ph.D. (2 de janeiro de 2019). As propriedades periódicas dos elementos. Recuperado de: pensamento.com
- Toppr. (s.F.). Propriedades do período dos elementos. Recuperado de: TOPPR.coma
- Propriedades periódicas dos elementos: uma jornada do outro lado da mesa é uma jornada pela química. [PDF]. Recuperado de: COD.Edu
- « Obsolescência fatores percebidos, consequências e exemplos
- História objectual da arte, características, representantes e obras »

